
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Індикатори даного методу
|
|
|
|
4. Криві титрування.
5. Індикаторні помилки.
Окисно-відновне титрування (редокс-метрия) засновано на реакціях окиснення - відновлення. При його проведенні речовина, яку титрують, вступає в окисно-відновну реакцію з титрантом. Якщо титрант-окисник, титрування називають окисним, при титранті–відновнику – відновним титруванням.
Окисно-відновних реакцій відомо багато (понад 90000). Для кількісного аналізу підходять тільки ті реакції, які:
1) протікають до кінця;
2) проходять швидко;
3) утворять продукти певної сполуки;
4) дозволяють фіксувати точку еквівалентності;
5) не вступають у побічні взаємодії;
6) є необоротними.
Необхідною умовою застосування реакції є можливість визначення точки еквівалентності, що залежить від величини ЕРС (різниці потенціалів реагуючих редокс-пар). ЕРС (електро-рушійна сила) при хімічній індикації повинна бути не менш 0,4-0,5V, при інструментальній - не менш 0,2V. У противному випадку реакція проходить або не до кінця, або при титруванні відсутній відповідний різкий стрибок потенціалу в зоні еквівалентності титрування. Індикацію кінця титрування стає дуже важко визначити.
Титрантами в методах редокс-метрії виступають розчини окисників і відновників. Залежно від умов вони можуть вступати в реакції, у яких бере участь різна кількість електронів. Тому часто титранти не мають постійного еквівалента. Наприклад, у кислому середовищі іон МnО4- приєднує 5 електронів і відновлюється до Мn2+, у лужному — 3 електрони й відновлюється до МnО2, у нейтральному — 1 електрон і відновлюється до МnО42-. Титранти методу характеризуються типом напівреакції, пов'язаним з кількістю переданих електронів і величиною окислювально-відновного потенціалу редокс-пари Е, від якого залежить застосування методу. Реальний потенціал редокс-пари титрантів-окисників відповідно повинен мати більше значення (на 0,4-0,5V), чим потенціал редокс-пари відновника, який титрують. Аналогічно для титранта-відновника витримують зворотну залежність.
У методах редокс-метрії частіше використовують в якості титрантів окисники у зв'язку з більшою стійкістю їхніх розчинів (розчин K2Cr2O7, наприклад, стійкий до 24 років). Розчини відновників менш стійкі (окиснення киснем повітря) і зберігаються нетривалий час.
В окисно-відновному титруванні є можливості регулювання потенціалу редокс-пари титранта й досліджуваної речовини, для чого використовують зміну рН середовища, комплексооутворюючі добавки, збільшення температури й т.д. Коло досліджуваних цим методом речовин широке завдяки великому набору титрантів і можливості регулювання процесу титрування.
На цей час розроблено понад 50 методів окислювально-відновного титрування. Їх називають за типом титранта, який застосовують в титруванні. Найбільш широке застосування одержали наступні види окисно-відновного титрування:
1) перманганатометрія — в якості титранту використовують розчин КMnO4;
2) йодиметрія — титрантом виступає розчин Na2S2O3 5H2O;
3) броматометрія — титрантом є розчин КВrО3;
4) дихроматометрія — титрант - розчин K2Cr2O7;
5) периметрія — як титрант використовують розчин СеO2 та ін. методи.
За типом виконання використовують кілька видів окисно-відновного титрування: пряме, зворотне й замісне.
Пряме титрування проводять при ЕРС>0,4V, що забезпечує необхідну повноту й швидкість протікання реакції. Прямим титруванням визначають, наприклад, йод, залізо (II) і ін.
Зворотне титрування використовується при окисно-відновних реакціях, що протікають досить повільно. При цьому до суміші, яку титрують, додають надлишок титранта I і витримують певний час (для повноти протікання реакції). Потім надлишок титранта I відтитровують іншим титрантом II. Такий спосіб застосовують, наприклад, при визначенні сульфідів.
Замісне титрування проводять, визначаючи замісник, тобто продукт, що виділяється в еквівалентній кількості, в реакції досліджуваної речовини з яким-небудь реактивом. Таким видом титрування аналізують речовини, що не вступають в окисно-відновні реакції. Наприклад, СаСО3 можна проаналізувати, розчиняючи його в НСl і після нейтралізації розчину осаджуючи (NH4)2C2O4 у вигляді осаду СаС2O4. Осад потім обробляють Н2SO4 і щавлеву кислоту, що виділився (замісник) титрують розчином перманганату калію.
В методах окиснення-відновлення для визначення точки еквівалентності застосовують інструментальні й індикаторні способи. З інструментальнихспособів широке застосування знайшли потенціометричне й амперометричне титрування. В індикаторних способах використовують:
а) окисно-відновні індикатори, що змінюють забарвлення при зміні окисно-відновного потенціалу системи;
б) специфічні індикатори, що змінюють своє забарвлення з появою титранта або зникненні досліджуванрї речовини.
Редокс-індикатори існують у двох формах — окисній Indок і відновленій Indвід, причому забарвлення однієї форми відрізняється від іншої.
Перехід індикатора з однієї форми в іншу й зміна його забарвлення відбувається при певному потенціалі переходу, що спостерігається при рівності концентрацій окисної й відновленої форм індикатора й за рівнянням Нернста - Петерса:

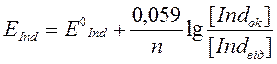
При умові [Indok] = [Indвід] Е дорівнює нормальному окисно-відновному потенціалу Е°. При цьому половина молекул індикатора існує в окисній, половина — у відновленій формі. Інтервал переходу індикатора (ІП), у якому відбувається помітна зміна його забарвлення, лежить у межах відносин концентрацій обох форм індикатора від 1/10 до 10/1.
Інтервал переходу редокс-індикаторів дуже невеликий на відміну від кислотно-основних індикаторів. Серед редокс-індикаторів розрізняють:
а) оборотні редокс-індикатори зворотно змінюють своє забарвлення при зміні потенціалу системи;
б ) необоротні редокс-індикатори піддаються необоротному окисненню або відновленню, у результаті чого забарвлення індикатора змінюється необоротно;
в) люмінесцентні індикатори, у розчинах яких при відповідному потенціалі з'являється люмінесценція.
З оборотних редокс-індикаторів часто застосовують наступні:
Дифеніламін відновлені форми безбарвні, окиснені форми мають фіолетово-синє забарвлення. Застосовують розчин 0,5М дифеніламіну в суміші 100см3 концентрованої сульфатної кислоти й 20см3 води.
Фенилантранілова кислота — карбонільне похідне дифеніламіну. Механізм перетворень її аналогічний як і для дифеніламіну. У відновленій формі індикатор безбарвний, в окисленій - червоно-фіолетових кольорів. Застосовують у вигляді 0,005М розчину натрієвої солі у воді.
Ферроїн — комплекс о-фенантролина із залізом (II), що має червоні кольори. В окисленій формі залізо (II) переходить у залізо (III), і індикатор набуває синє забарвлення.
Метиленовий синій — окислена форма має синьо-зелене забарвлення, відновлена форма – розчин безбарвний. Застосовують 0,15%-ный розчин метиленового синього у воді, часто - у суміші із тропеолином 00. При цьому забарвлення розчину змінюється із червоно - фіолетового на блакитне.
При проведенні окисно-відновного титрування необхідно підбирати індикатор таким чином, щоб потенціал переходу індикатора перебував у межах стрибка потенціалу на кривій титрування. Багато індикаторів окисно-відновного титрування мають кислотні або основні властивості й можуть міняти своє поводження залежно від рН середовища. У таких випадках титрування ведуть, створивши необхідний рН.
Специфічні індикатори застосовують у ряді методів окиснення — відновлення. Найбільше часто застосовують крохмаль — індикатор на присутність вільного йоду, вірніше, трийодид-іонів II. У присутності йоду крохмаль при кімнатній температурі синіє. При стоянні розчину крохмалю проходить гідроліз і забарвлення із синього перетворюється в червоне. Тому рекомендується застосовувати свіжоприготовлений 1% розчин крохмалю. Застосовують також і ряд інших індикаторів.
При аналізі речовин, що окиснюються або відновлюються необхідно підібрати підходящий для даних умов титрант, визначити можливість титрування й спосіб фіксації точки еквівалентності - індикаторний або інструментальний. Дослідження процесу титрування в редокс-метрії здійснюють за допомогою кривих титрування. При титруванні відбувається зміна потенціалу редокс-пари досліджуваної речовини й титранта. Внаслідок того, що міняється співвідношення окисненої й відновленої форм обох пар, потенціали редокс-пар визначають рівнянням Нерста - Петерса:
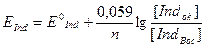
і їх можна розрахувати для будь-якого моменту титрування. Крива титрування виражає графічну залежність потенціалу редокс-пари досліджуваної речовини або титранта від об'єму доданого титранта.
Індикаторні помилки окисно-відновного титрування викликані розбіжністю точки кінця титрування (ТКТ) із точкою еквівалентності (ТЕ). Для розрахунку цих помилок не потрібно знати об'єм титранта і концентрації реагуючих речовин. Використовують співвідношення концентрацій окисленої й відновленої форм редокс-пари в ТКТ, що визначається з рівняння Нернста. Останнє складається з обліком, що потенціали в ТКТ дорівнює потенціалу редокс-індикатора.
Для розрахунку помилки необхідні наступні дані:
1) стандартні потенціали реагуючих редокс-пар;
2) потенціал у ТЕ;
3) інтервал переходу редокс-індикатора.
Індикатор уважається прийнятним, якщо помилка становить не більше 0,1-0,2 %.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1660; Нарушение авторских прав?; Мы поможем в написании вашей работы!