
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Распределение молекул по скоростям
|
|
|
|
Молекулы газа, находящегося в сосуде, двигаясь хаотически, непрерывно сталкиваются друг с другом и обмениваются энергией. В результате этого скорости молекул газа, который находится в равновесном состоянии, могут иметь самые разные значения – и очень большие, и близкие к нулю. Следовательно, скорость молекулы – непрерывная случайная величина. Но неправомерно ставить вопрос, какова вероятность того, что скорость молекулы равна, например, 150,75 м/с. Если бы была возможность одновременно и совершенно точно измерить скорости всех молекул в данном объеме газа, то среди них не нашлось бы молекулы точно с такой скоростью, но были бы молекулы, со скоростями, близкими к этому значению. Поэтому можно говорить лишь о вероятности  того, что величина скорости молекулы лежит в некотором интервале скоростей
того, что величина скорости молекулы лежит в некотором интервале скоростей  . Эту вероятность можно определить так же, как это делалось в предыдущем примере с шарами:
. Эту вероятность можно определить так же, как это делалось в предыдущем примере с шарами:  , где
, где 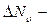 число молекул, величина скорости которых лежит в интервале
число молекул, величина скорости которых лежит в интервале 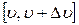 ,
,  общее число молекул газа.
общее число молекул газа.
 Отложим интервал возможных значений скорости
Отложим интервал возможных значений скорости  на оси абсцисс. Разобьем весь интервал на отрезки шириной
на оси абсцисс. Разобьем весь интервал на отрезки шириной  . На этих отрезках построим столбики, высота которых
. На этих отрезках построим столбики, высота которых 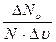 представляет собой плотность вероятности
представляет собой плотность вероятности 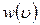 нахождения молекул в интервале скоростей
нахождения молекул в интервале скоростей  . Полученная столбчатая диаграмма называется гистограммой (рис. 8.2.1). Площадь каждого столбика равна
. Полученная столбчатая диаграмма называется гистограммой (рис. 8.2.1). Площадь каждого столбика равна  , площадь всей гистограммы, в соответствии с условием нормировки, равна единице, что физически означает равенство единице полной вероятности
, площадь всей гистограммы, в соответствии с условием нормировки, равна единице, что физически означает равенство единице полной вероятности  нахождения молекул во все интервале скоростей от нуля до бесконечности.
нахождения молекул во все интервале скоростей от нуля до бесконечности.
 В пределе при
В пределе при  огибающая столбиков превращается в гладкую кривую (рис. 8.2.2), которую можно задать аналитически в виде функции
огибающая столбиков превращается в гладкую кривую (рис. 8.2.2), которую можно задать аналитически в виде функции  , которая носит название функции распределения молекул по скоростям. Тогда вероятность
, которая носит название функции распределения молекул по скоростям. Тогда вероятность  того, что величина скорости молекул лежит в интервале
того, что величина скорости молекул лежит в интервале  , равна
, равна  и определяется площадью заштрихованной фигуры. С другой стороны,
и определяется площадью заштрихованной фигуры. С другой стороны,  равна относительному числу молекул, скорости которых лежат в указанном интервале:
равна относительному числу молекул, скорости которых лежат в указанном интервале:  .
.
Полная площадь фигуры на рис. 8.2.2, ограниченной осями координат и кривой  , имеет смысл полной вероятности и равна единице:
, имеет смысл полной вероятности и равна единице:
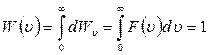 .
.
Функция распределения  молекул газа по абсолютным значениям скоростей была получена Максвеллом и является справедливой для идеального газа, состоящего из одинаковых частиц, находящегося в состоянии равновесия, в отсутствии внешних силовых полей. Аналитически функция
молекул газа по абсолютным значениям скоростей была получена Максвеллом и является справедливой для идеального газа, состоящего из одинаковых частиц, находящегося в состоянии равновесия, в отсутствии внешних силовых полей. Аналитически функция  задается следующим
задается следующим
выражением:  , где
, где 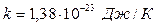 (постоянная
(постоянная
Больцмана). Константа  находится из условий нормировки:
находится из условий нормировки:  . Вычислив интеграл, получим выражение для константы:
. Вычислив интеграл, получим выражение для константы:  .
.
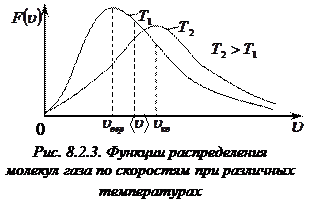 С учетом этого результата функцию Максвелла – функцию распределения молекул газа по абсолютным значениям скоростей – можно записать в следующем виде:
С учетом этого результата функцию Максвелла – функцию распределения молекул газа по абсолютным значениям скоростей – можно записать в следующем виде:
 .
.
При увеличении температуры максимум функции сдвигается в сторону больших значений скорости, при этом максимум становится ниже, поскольку площадь под кривой, в соответствии с условием нормировки, остается постоянной и равна единице (рис. 8.2.3).
Так как  , где
, где 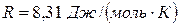 (универсальная газовая постоянная), то функции распределения молекул по скоростям можно придать вид:
(универсальная газовая постоянная), то функции распределения молекул по скоростям можно придать вид:  . Умножив соответствующую вероятность
. Умножив соответствующую вероятность  на
на
полное число молекул газа  , получим число молекул
, получим число молекул  , модуль скорости которых лежит в интервале
, модуль скорости которых лежит в интервале  . Чтобы найти число молекул
. Чтобы найти число молекул  , модуль скорости которых лежит в пределах значений от
, модуль скорости которых лежит в пределах значений от  до
до  , необходимо провести интегрирование:
, необходимо провести интегрирование:
 . (8.2.1)
. (8.2.1)
Функция 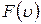 имеет максимум при значении скорости
имеет максимум при значении скорости
 , (8.2.2)
, (8.2.2)
которое вычисляется из условия  и называется наиболее вероятной скоростью.
и называется наиболее вероятной скоростью.
Средняя скорость молекул  определяется по формуле:
определяется по формуле:
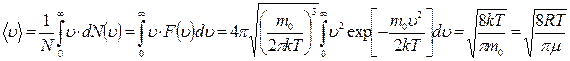 .(8.2.3)
.(8.2.3)
Среднее значение квадрата скорости 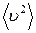 найдем по формуле:
найдем по формуле:
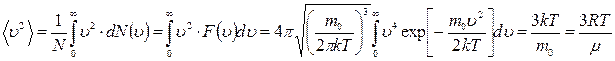 .
.
Величина  называется средней квадратичной скоростью и равна
называется средней квадратичной скоростью и равна
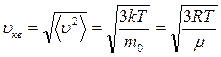 . (8.2.4)
. (8.2.4)
Исходя из распределения молекул по скоростям, можно найти распределение молекул газа по значениям кинетической энергии  . Для этого перейдем от перемен-
. Для этого перейдем от перемен-
ной  к переменной
к переменной  . Подставив в функцию распределения
. Подставив в функцию распределения  и
и  , получим
, получим  .
.
Тогда средняя кинетическая энергия  молекулы идеального газа
молекулы идеального газа
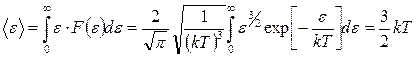 . (8.2.5)
. (8.2.5)
Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа. При 
 , следовательно, при 0 К прекращается поступательное движение молекул газа и становится равным нулю давление газа на стенки сосуда.
, следовательно, при 0 К прекращается поступательное движение молекул газа и становится равным нулю давление газа на стенки сосуда.
Среднюю энергию поступательного движения молекулы газа можно найти, также используя среднюю квадратичную скорость:
 . (8.2.6)
. (8.2.6)
 Пример 8.2.1. В некотором объеме газа содержится число молекул, равное
Пример 8.2.1. В некотором объеме газа содержится число молекул, равное  . Рассматривая этот газ как идеальный, определить число
. Рассматривая этот газ как идеальный, определить число  молекул, скорости которых
молекул, скорости которых  меньше 0,001 наиболее вероятной скорости.
меньше 0,001 наиболее вероятной скорости.

 Решение:
Решение:
 Для решения этой задачи удобно воспользоваться распределением молекул по относительным скоростям. Пусть
Для решения этой задачи удобно воспользоваться распределением молекул по относительным скоростям. Пусть  относительная скорость, равная отношению абсолютной скорости
относительная скорость, равная отношению абсолютной скорости 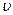 к наиболее вероятной скорости
к наиболее вероятной скорости  :
: . Подставив в функцию распределения молекул по абсолютным значениям скорости
. Подставив в функцию распределения молекул по абсолютным значениям скорости  и
и  , получим функцию распределения молекул по относительным скоростям:
, получим функцию распределения молекул по относительным скоростям:  . Тогда число молекул
. Тогда число молекул  , относительные скорости
, относительные скорости  которых заключены в пределах от
которых заключены в пределах от  до
до  , определяется формулой
, определяется формулой  .
.
Разложим экспоненту в ряд:  . По условию задачи, максимальная скорость молекул
. По условию задачи, максимальная скорость молекул  , откуда
, откуда 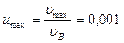 . Для таких значений
. Для таких значений  можно пренебречь всеми слагаемыми, кроме 1. Следовательно,
можно пренебречь всеми слагаемыми, кроме 1. Следовательно, 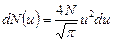 . Интегрируя это выражение по скорости в пределах от 0 до
. Интегрируя это выражение по скорости в пределах от 0 до  , получим
, получим  . Подставив в эту формулу значения всех величин и произведя вычисления, получим
. Подставив в эту формулу значения всех величин и произведя вычисления, получим  молекул.
молекул.
Ответ:  молекул.
молекул.
Пример 8.2.2. Найти для кислорода при температуре  наиболее вероятную, среднюю и среднюю квадратичную скорости молекул. Определить относительное число молекул
наиболее вероятную, среднюю и среднюю квадратичную скорости молекул. Определить относительное число молекул 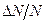 , скорости которых отличаются от наиболее вероятной не более, чем на 2 %.
, скорости которых отличаются от наиболее вероятной не более, чем на 2 %.
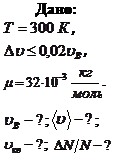
 Решение:
Решение:
 Наиболее вероятная скорость по 8.2.2
Наиболее вероятная скорость по 8.2.2  .
.
Средняя скорость по 8.2.3  .
.
Средняя квадратичная скорость по 8.2.4  .
.
Интервал значений скорости молекул  . Поэтому можно считать, что
. Поэтому можно считать, что  . Следовательно,
. Следовательно,  .
.
С учетом того, что 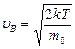 , получим
, получим  .
.
Ответ: 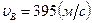 ,
,  ,
,  ,
,  .
.
Пример 8.2.3. Колба вместимостью 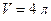 содержит газ массой
содержит газ массой  под давлением
под давлением 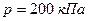 . Определить среднюю квадратичную скорость
. Определить среднюю квадратичную скорость  молекул газа.
молекул газа.

 Решение:
Решение:
 Средняя квадратичная скорость молекул идеального газа по 8.2.4 зависит от температуры
Средняя квадратичная скорость молекул идеального газа по 8.2.4 зависит от температуры  . Давление газа связано с концентрацией его молекул по 7.4.2 соотношением
. Давление газа связано с концентрацией его молекул по 7.4.2 соотношением  , где
, где 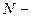 количество молекул газа в сосуде. Учитывая, что
количество молекул газа в сосуде. Учитывая, что  , получим
, получим  , откуда
, откуда 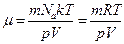 .
.
Подставим в формулу для средней квадратичной скорости

Ответ:  .
.
Пример 8.2.4. Найти среднее число столкновений в единицу времени молекул азота при давлении  и температуре
и температуре  . Эффективный диаметр молекулы азота
. Эффективный диаметр молекулы азота 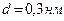 .
.
 Решение:
Решение:
 Из уравнений
Из уравнений (по 7.4.2) и
(по 7.4.2) и 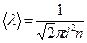 (по 7.3.4) имеем
(по 7.3.4) имеем 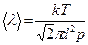 . Среднее число столкновений
. Среднее число столкновений  , где
, где  .
.
Следовательно,
 .
.
 Ответ:
Ответ:  .
.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2683; Нарушение авторских прав?; Мы поможем в написании вашей работы!