
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия реального газа
|
|
|
|
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Наличие сил притяжения приводит к появлению внутреннего давления на газ:
 .
.
Работа, которая затрачивается для преодоления сил притяжения, действующих между молекулами газа (против внутреннего давления), идет на увеличение потен-
циальной энергии системы
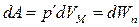 ,
,
откуда  и
и 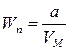 .
.
С учетом этого слагаемого, внутренняя энергия моля реального газа равна:
 , (11.3.1)
, (11.3.1)
где  кинетическая энергия теплового движения молекул газа, со-
кинетическая энергия теплового движения молекул газа, со-
держащихся в одном моле (учли, что  и
и 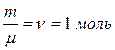 ). Таким образом, внутренняя энергия реального газа растет с повышением температуры и объема.
). Таким образом, внутренняя энергия реального газа растет с повышением температуры и объема.
Если газ расширяется без теплообмена с окружающей средой (адиабатически), не совершая при этом внешней работы (в вакууме), то 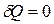 и
и  . Следовательно, на основании первого начала термодинамики
. Следовательно, на основании первого начала термодинамики  , т.е.
, т.е.  .
.
Следовательно, при адиабатическом расширении без совершения внешней работы внутренняя энергия газа не изменяется.
Это равенство формально выполняется и для идеального газа, но тогда, если  , это означает равенство температур
, это означает равенство температур  , т.е. при адиабатическом расширении идеального газа в вакууме температура не изменяется. Для реального газа
, т.е. при адиабатическом расширении идеального газа в вакууме температура не изменяется. Для реального газа 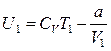 ;
;  , и, следовательно,
, и, следовательно,  , откуда
, откуда
 .
.
Так как  , то
, то  , т.е. реальный газ при этом процессе охлаждается. При адиабатическом сжатии он будет нагреваться.
, т.е. реальный газ при этом процессе охлаждается. При адиабатическом сжатии он будет нагреваться.
Измерение температуры реального газа в результате его адиабатического расширения, или, как говорят, адиабатического дросселирования – медленного прохождения газа под действием перепада давлений сквозь дроссель (пористую перегородку) – называется эффектом Джоуля-Томсона.
В зависимости от условий дросселирования для одного и того же газа эффект Джоуля-Томсона может быть как положительным (газ охлаждается), так и отрицательным (газ нагревается). Температура, при которой для данного давления происходит изменение знака эффекта Джоуля-Томсона, называется температурой инверсии. Зависимость температуры инверсии  от объема имеет вид:
от объема имеет вид:
 (11.3.2)
(11.3.2)

Пример 11.3.1. В баллоне емкостью  находится
находится  кислорода при температуре
кислорода при температуре  . Определить: 1) какую часть объема сосуда составляет собственный объем молекул газа; 2) какую часть давления газа на стенки сосуда составляет внутреннее давление, обусловленное силами притяжения молекул. Для кислорода критическое значение температуры
. Определить: 1) какую часть объема сосуда составляет собственный объем молекул газа; 2) какую часть давления газа на стенки сосуда составляет внутреннее давление, обусловленное силами притяжения молекул. Для кислорода критическое значение температуры  , критическое значение давления
, критическое значение давления  .
.

 Решение:
Решение:
Критические параметры связаны с поправками в уравнении Ван-дер-Ваальса (11.2.1)  ,
,  .
.
Решая совместно систему этих уравнений, найдем, что  ,
,  .
.
Собственный объем молекул 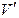 , содержащихся в массе газа
, содержащихся в массе газа  , равен:
, равен:  .
.
Следовательно, молекула газа занимает  часть объема сосуда. Или
часть объема сосуда. Или 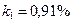 .
.
2) Внутреннее давление  , обусловленное силами притяжения молекул, равно
, обусловленное силами притяжения молекул, равно 
 . Из уравнения Ван-дер-Ваальса давление
. Из уравнения Ван-дер-Ваальса давление , производимое газом на стенки сосуда, равно
, производимое газом на стенки сосуда, равно  . Следовательно, дополнительное давление составляет
. Следовательно, дополнительное давление составляет  часть общего давления газа. Или
часть общего давления газа. Или  .
.
Ответ: 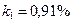 ,
,  .
.
Пример 11.3.2. Определить давление 280 г азота, находящегося при температуре 270 С в сосуде, объем которого равен: 1) 1 м3; 2) 1 л. Поправки в уравнении Ван-дер-Ваальса для азота равны  ,
,  .
.

 Решение:
Решение:
Чтобы решить вопрос о том, каким следует считать данный газ – идеальным или реальным, найдем молярный объем газа  . Пусть в сосуде содержится
. Пусть в сосуде содержится 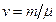 молей газа. Тогда
молей газа. Тогда  .
.
Т.к. для азота  , то
, то
1)  ; 2)
; 2)  .
.
Сравнивая полученные значения с молярным объемом газа при нормальных условиях  , видим, что в первом случае
, видим, что в первом случае  , газ можно считать идеальным. Уравнение идеального газа для одного моля:
, газ можно считать идеальным. Уравнение идеального газа для одного моля:  , откуда
, откуда
 .
.
Во втором случае 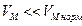 , следовательно, газ следует считать реальным. Уравнение Ван-дер-Вальса для одного моля:
, следовательно, газ следует считать реальным. Уравнение Ван-дер-Вальса для одного моля:  .
.
 Ответ: 1)
Ответ: 1)  ; 2)
; 2)  .
.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1348; Нарушение авторских прав?; Мы поможем в написании вашей работы!