
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая связь, ее природа и типы
|
|
|
|
ХИМИЧЕСКИЕ И МЕЖМОЛЕКУЛЯРНЫЕ СИЛЫ
ВАЖНЕЙШИЕ КЛАССЫ И НОМЕНКЛАТУРА ВЕЩЕСТВ
Все вещества делятся на простые (состоящие из атомов одного элемента) и сложные (из атомов двух и более элементов). Простые вещества подразделяются на металлы и неметаллы (H, B, C, N, O, F, Si, P, S, Cl, As, Se, Br, Te, I, At, He, Ne, Ar, Kr, Xe и Rn). Сложные вещества делятся на неорганические и органические. Вещества могут быть низкомолекулярными (состоят из небольших молекул) и высокомолекулярными или полимерными (состоят из макромолекул – больших молекул, построенных из повторяющихся звеньев-мономеров, число которых может достигать десятков тысяч и более).
Язык химии – химические символы элементов, формулы, уравнения. Символы химических элементов, их написание и названия приведены в периодической таблице элементов Менделеева. Так как уже известно более 6 миллионов химических соединений, то возникает необходимость в их классификации, разработке единой и строгой системы принципов построения их формул и названий. Такой системой в химии является химическая номенклатура. Наиболее используемая – номенклатура ИЮПАК, называемая международной.
По правилам номенклатуры ИЮПАК каждое вещество в соответствие с его формулой получает систематическое название, полностью отражающее его состав. Таких равноценных названий может быть несколько. Например, SO3 - оксид серы (VI) или триоксид серы. Для некоторых соединений (распространенные кислоты, их соли и др.) допускается использование традиционных названий. Например, H2SO4 - серная кислота, систематическое – тетрасульфат (VI) водорода. Кроме того, эти же правила допускают использование и небольшого числа несистемных специальных названий. Например, аммиак, аммоний, гидразин. На практике, в технической и учебной литературе применяются и другие несистемные названия: тривиальные – соляная кислота, сода, негашеная известь, едкий натр и др., минералогические – рутил, малахит, молибденит и др.
Химическая связь – связь, возникшая между атомами вследствие перераспределения между ними электронов (электронных облаков).
Основным условием образования химической связи является понижение полной энергии многоатомной системы в сравнении с суммарной энергией изолированных атомов.
Химическая связь – это взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.
Различают 3 типа химической связи: ковалентная, ионная и металлическая. Основными параметрами химической связи являются: длина (межъядерное расстояние связанных атомов), прочность (энергия, выделяющаяся при образовании или затрачиваемая на разрыв связи), валентный угол или угол связи (угол между прямыми, проходящими через ядра связанных атомов), полярность (дипольный момент).
Ковалентная связь (атомная связь, гомеополярная связь) –связь, обусловленная наличием электронных пар, общих для соединяющихся атомов.
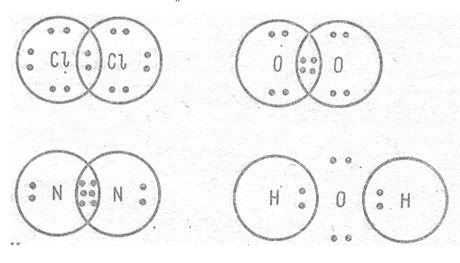
Рис. 4.1. Ковалентная связь
Ионная связь – тип химической связи, энергия которой в основном определяется электростатическими силами притяжения противоположно заряженных ионов (катионов и анионов).
Более строго ее следует рассматривать как предельный случай ковалентной полярной связи, так как реально полного разделения зарядов, т.е. перехода электрона от одного атома к другому, никогда не происходит.
Ионная связь в отличие от ковалентной связи характеризуется ненаправленностью и ненасыщенностью (ионы представляются в виде электрических зарядов со сферической симметрией).
В целом ионное соединение представляют как гигантскую ассоциацию ионов противоположных знаков, а химические формулы ионных соединений – как простейшее соотношение между числом атомов элементов, входящих в состав такой ассоциации.
Металлическая связь по своей природе подобна ковалентной связи: оба типа связи основаны на обобществлении валентных электронов. Однако в атомах металло количество таких электронов значительно меньше количества свободных орбиталей, поэтому они могут вследствие невысоких энергий ионизации металлов свободно переходить из одной орбитали в другую. Благодаря свободному перемещению электронов по всему объему металлическая связь является нелокализованной и ненеправленной, а металлы обладают высокой электро- и теплопроводностью.
Упрощенно металл можно рассматривать как гигантскую молекулу, построенную из катионов, связанных меду собою относительно свободно перемещающимися между ними валентными электронами (электронным газом).
Донорно-акцепторная связь. Образование ковалентной связи возможно и при взаимодействии атомов, один из которых имеет пару электронов, называемую неподеленной, а другой – свободную орбиталь. Эта электронная пара становится общей для обоих атомов. Донор – атом, предоставляющий электронную пару, а участвующий в обоществлении пары за счет свободной орбитали атом – акцептор. Такая связь называется донорно-акцепторной.
Классический пример – образование иона аммония:
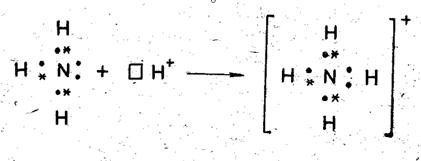
Рис. 4.2. Донорно-акцепторная связь
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 3999; Нарушение авторских прав?; Мы поможем в написании вашей работы!