
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические реакции
|
|
|
|
Скорость химической реакции – это число актов взаимодействия в единицу времени в единице объема (гомогенная среда, состоящая из одной фазы) или на единице поверхности (гетерогенная система, состоящая из нескольких фаз).
Вещество как однородная по составу молекулярная система может находиться в трех качественно отличающихся состояниях (газообразном, жидком и кристаллическом), которые называются фазами, если дополнительно накладываемым ограничением является условие термодинамического равновесия (физика) или условие наличия поверхностей раздела (химия).
Скорость химической реакции количественно можно характеризовать изменением концентрации (обычно молярной) любого участника реакции в единицу времени (обычно в секундах).
Основные факторы, влияющие на скорость химической реакции: природа реагирующих веществ, их концентрацифя, давление (если в реакции участвуют газы), температура, катализаторы, площадь поверхности раздела фаз (гетерогенные реакции).
Различают элементарные (протекающие в одну стадию) и сложные (включающие несколько стадий, состоящие из нескольких элементарных процессов) ракции.
Для элементарных реакций справедлив закон действия (действующих) масс:
“скорость элементарной химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, равными стехтометрическим коэффициентам в уравнении реакции”.

где 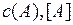 и
и  – молярные концентрации реагирующих веществ
– молярные концентрации реагирующих веществ
А и В, а k – константа скорости реакции, если  и
и 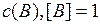 , и зависящая от природы реагирующих веществ, температуры, катализаторов, а также площади поверхности раздела фаз (для гетерогенных реакций).
, и зависящая от природы реагирующих веществ, температуры, катализаторов, а также площади поверхности раздела фаз (для гетерогенных реакций).
Выражение зависимости скорости реакции от концентрации называют кинетическим уравнением.
В случае сложных реакций закон действия масс применим к каждой отдельной стадии.
Влияние температуры на скорость химической реакции в теории активации выражается уравнением Аррениуса:
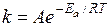 ,
,
где A – постоянный множитель, не зависящий от температуры; R – универсальная газовая постоянная; Еа – энергия активации; e – основание натурального логарифма.
Энергия активации – разность между средней энергией реагирующих частиц и энергией активированного комплекса.
Еа является характеристикой реакции и определяет влияние на скорость реакции природы реагирующих частиц. Для большинства реакций энергия активации меньше энергии диссоциации наименее прочной связи в молекулах реагирующих веществ. Даже небольшое снижение энергии активации ведет к значительному увеличению скорости реакции. Влияние температуры на скорость реакции увеличивается с увеличением энергии активации.
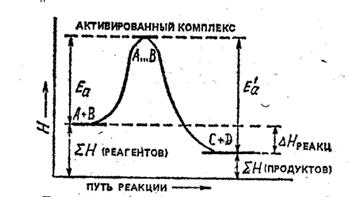
Рис. 4.3. Энергетическая схема хода реакции А + В = С + D
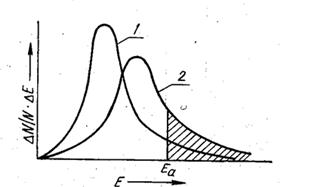
Рис. 4.4. Распределение молекул газа по кинетической энергии Е
при разных температурах (T2 > T1): 1 - T1; 2 – T2
Катализ – явление изменения скорости химической реакции в присутствии особых веществ (катализаторов) в результате измения пути протекания реакции.
Катализаторы – вещества, изменяющие скорость химической реакции вследствие многократного участия в промежуточном химическом взаимодействии с реагентами реакции, но после каждого цикла промежуточного взаимодействия восстанавливают свой химический состав.
Положительные катализаторы ускоряют реакцию, отрицательные (ингибиторы) – замедляют ее. Ускорение реакции связано, как правило, с уменьшением энергии активации.
Различают гомогенный (катализатор и реагирующие вещества образуют одну фазу) и гетерогенный (находятся в разных фазах) катализ.
Большинство реакций являются обратимыми:
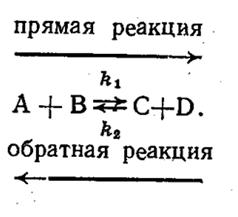
Рис 4.5
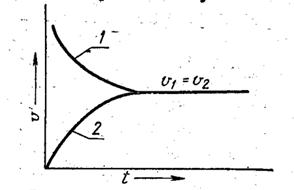
Рис. 4.6. Изменение скорости прямой (1) и обратной (2) реакций
с течением времени
Химическое равновесие – состояние, при котором скорости прямой и обратной реакций равны: 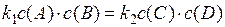
Оно является динамическим равновесием, т.е. реакции не прекращаются. При этом концентрации всех веществ постоянны.
Из условия равновесия: 
Kc – константа химического равновесия (термодинамическая величина, не зависящая от пути протекания процесса, включая введение катализаторов, но зависящая от природы реагирующих веществ и температуры).
Уравнение является математическим выражением закона действия масс применительно к обратимым процессам.
В общем случае для любой обратимой химической реакции
 :
: 
Химическое равновесие между газообразными веществами при небольших давлениях выражается через парциальные давления участвующих в реакции веществ: 
Константа равновесия Kp определяет глубину протекания реакции к моменту достижения равновесного состояния. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
В состоянии химического равновесия  .
.
Изменение условий (T, p, с) может вызывать нарушение равновесия вследствие неодинакового изменения скоростей прямой и обратной реакций. В итоге система из одного равновесного состояния переходит в другое равновесное состояние (сдвиг или смещение положения равновесия).
Направление сдвига определяется принципом Ле Шателье:
«Если изменить одно из условий, при которых система находится в состоянии истинного химического равновесия, то положение равновесия сместится в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия».
При изменении p и T направление сдвига определяется знаком при 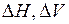 , степень – их величинами (
, степень – их величинами ( – изменение энтальпии). При изменении с степень сдвига определяется стехиометрическими коэффициентами, направление – избыточным реагентом.
– изменение энтальпии). При изменении с степень сдвига определяется стехиометрическими коэффициентами, направление – избыточным реагентом.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 541; Нарушение авторских прав?; Мы поможем в написании вашей работы!