
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Состояния вещества
|
|
|
|
АГРЕГАТНЫЕ, ФАЗОВЫЕ И РЕЛАКСАЦИОННЫЕ
Межмолекулярное взаимодействие
Молекулы способны взаимодействовать между собою (обладают ненасыщенными силами притяжения-отталкивания, которые называются межмолекулярными или ван-дер-ваальсоыми силами - МС). Как и химические силы они имеют электричеакую природу, обеспечивая переход вещества из одного агрегатного состояния в другое (газообразное, жидкое, твердое).
3 типа межмолекулярных сил:
Ориентационное (диполь-дипольное) взаимодействие – результат взаимной ориентации соответствующих полюсов полярных молекул при их взаимном сближении.
Индукционное взаимодействие – электростатическое взаимодействие полярной и неполярной молекул.
Дисперсионное взаимодействие – результат притяжения мгновенных диполей (самое универсальное взаимодействие). Оно проявляется между любыми, включая неполярные, молекулами.
Практически все вещества могут существовать в твёрдом, жидком и газообразном агрегатных состояниях, переходы между которыми сопровождаются скачкообразными изменениями механических, физических и химических свойств вещества (например, его плотности). Жидкое и твёрдое состояния называют конденсированным состоянием. Четвёртым агрегатным состоянием часто называют плазму.
В твёрдом и жидком состояниях вещества могут быть аморфными (неупорядоченными, бесструктурными), кристаллическими или аморфно-кристаллическими.
Твердые, жидкие и газообразные вещества могут находиться в равновесном и неравновесном состояниях.
Равновесные состояния веществ изучает фазовая теория вещества. Согласно ей низкомолекулярное вещество может находиться в 3-х состояниях устойчивого равновесия (фазах): твёрдом (кристаллическое состояние, дальний порядок расположения частиц: атомов или молекул), жидком (аморфно-кристаллическое состояние с ближним порядком расположения частиц в нанокластерных ансамблях) и газообразном (преобладание одиночных частиц и их парных столкновений). Высокомолекулярные (полимерные) вещества могут находиться в жидком кристаллическом состоянии. Между фазами существуют переходные состояния – фазовые переходы 1-го рода (состояния неустойчивого равновесия): газ – жидкость (конденсация, испарение), жидкость – твёрдый кристалл (кристаллизация, плавление) и твёрдый кристалл – газ (сублимация-возгонка и конденсация).
Для описания поведения вещества фазовая теория использует уравнения состояния – уравнения, связывающие переменную состояния вещества (например, объём) и управляющие ею параметры (например, температуру и давление). Для описания поведения идеальных и идеальных (частицы не имеют объёма, между ними не действуют силы притяжения-отталкивания) и разреженных газов используют уравнение состояния Клапейрона-Менделеева:
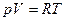 ,
,
где p – давление, V – объём, T – температура, R – газовая постоянная.
Для системы «жидкость-газ» используют эмпирическое уравнение Ван дер Ваальса:
 ,
,
где b – собственный объем молекул,  – параметр, учитывающий притяжение молекул.
– параметр, учитывающий притяжение молекул.
В состоянии конкретной формы равновесия (например, в газообразном состоянии) вещество находится при определенном сочетании значений входящих в уравнение состояния параметров. Так как для перехода из одного равновесного состояния в другое равновесное состояние необходимо время (структурно-кинетические единицы вещества характеризуются определенным временем, необходимым для изменения их положения, называемым временем релаксации, то если для находящееся в условиях равновесия вещества быстро изменить параметры на те, которые соответствуют другому равновесному состоянию, то состояние вещества окажется неравновесным и может существовать в этом состоянии долгое (иногда неограниченно долгое) время. Если первоначальное состояние вещества было жидким, а условия изменили на те, которые характерны для твердого состояния, то неравновесное твёрдое состояние вещества называется «стеклообразным состоянием». Самый известный пример – обычное оконное стекло, несколько менее известный – органическое стекло (плексигласс, полиметилметакрилат). Термин «неравновесное состояние» используют также для характеристики плотных структурно неупорядоченных дисперсных систем (порошков, множества шариков и т.д.). Иногда стеклоподобные вещества и относительно плотные дисперсные системы объединяют термином «jammed matter» (сжатое, уплотнённое состояние).
Существует также понятие релаксационное (кинетическое) состояние аморфного вещества. Эти состояния наиболее ярко проявляются в полимерах – высокомолекулярных веществах. Они связаны с соотношением скорости механического или электрического воздействия на вещество и временем релаксации его основных структурно-кинетических единиц (макромолекул, их сегментов). Если время воздействия достаточное для того, чтобы могли перемещаться макромолекулы, то такое состояние называется вязко-текучим, а если только их сегменты – высокоэластическим. Если нет возможности перемещаться и сегментам, а только могут осуществляться крутильные движения или колебания атомов или их небольших групп, то такое состояние является стеклообразным. При этом уменьшение температуры испытаний качественно эквивалентно увеличению скорости воздействия (деформации), то есть реализуется температурно-временная аналогия (суперпозиция).
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 675; Нарушение авторских прав?; Мы поможем в написании вашей работы!