
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные электрохимические характеристики ИСЭ
|
|
|
|
Основными электрохимическими характеристиками любого ИСЭ являются:
§ интервал выполнения электродной функции;
§ крутизна электродной функции;
§ предел определения потенциалопределяющего иона;
§ коэффициент селективности;
§ время отклика ИСЭ.
Все характеристики, кроме времени отклика, определяются по графику зависимости потенциала ИСЭ от p A (рис. 20). По характеристикам ИСЭ делают вывод о работоспособности электрода.

Рис. 20. Интервал выполнения (Нернстовская область) электродной функции
Интервал выполнения (Нернстовская область) электродной функции – это интервал прямолинейной зависимости потенциала электрода (Е) от отрицательного логарифма активности иона А (р А).
Крутизна (наклон) электродной функции – это угловой коэффициент наклона графика. Он определяет чувствительность ИСЭ и численно равен предлогарифмическому множителю в уравнении Нернста (рис. 21).

Рис. 21. Крутизна электродной функции
Таким образом, для однозарядных ионов эта величина должна составлять 58 мВ при 20оС, для двухзарядных – 29 мВ и т. д.
Предел определения потенциалопределяющего иона (Сmin, p) – это минимальная концентрация иона, определяемая с заданной достоверностью с помощью данного ИСЭ. Для определения Сmin , p чаще всего экстраполируют линейные участки зависимости Е – р A. Полученная точка пересечения соответствует на оси абсцисс величине –lg Сmin, p (рис.22).
Коэффициент селективности (k А,В) показывает возможность работы электрода в присутствии мешающих ионов и отражает влияние посторонних ионов В на потенциал электрода, селективного к ионам А. Чем меньше величина k А,В, тем выше селективность электрода.
Время отклика – это время достижения стационарного потенциала. Обычно для относительно концентрированных растворов (10–4–10–2 М) время отклика не превышает 10–15 с, но для разбавленных растворов (10–5 М) может достигать нескольких минут. Время отклика зависит от типа электрода.

Рис. 22. Предел определения потенциалопределяющего иона
 Стеклянный электрод
Стеклянный электрод
Одним из ионоселективных электродов, очень широко используемым в аналитической практике, является стеклянный электрод.
Стеклянный электрод – это ИСЭ, чувствительный к ионам Н+.
Он состоит из следующих элементов (рис. 23):
§ стеклянной рН-чувствительной мембраны (1);
§ внутреннего раствора с постоянной концентрацией ионов Н+ (чаще всего – 0,1 М HCl или буферный раствор) (2);
§ внутреннего хлоридсеребряного электрода сравнения (3).
Мембрана изготовлена из специального сорта стекла. При погружении электрода в раствор сначала ионы щелочных металлов Ме+ (Ме+ = Na+, Li+) из стекла обмениваются на ионы Н+ из раствора:
Ме+(ст) + Н+(р) «Ме+(р) + Н+(ст),
затем на внутренней и внешней поверхностях стеклянной мембраны устанавливается равновесие:
Н+(ст) «Н+(р). (3)
Если активности иона Н+ во внешнем и внутреннем растворах ( и
и 
 ) неодинаковы, то возникает разность потенциалов:
) неодинаковы, то возникает разность потенциалов:
§ при 2 ≤ рН ≤ 9 уравнение Нернста для стеклянного электрода имеет вид:
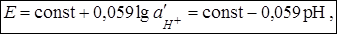
где const – постоянная величина, которая зависит от вида стекла, температуры и  . В неё входят потенциалы внешнего и внутреннего электродов сравнения и потенциал асимметрии.
. В неё входят потенциалы внешнего и внутреннего электродов сравнения и потенциал асимметрии.
Потенциал асимметрии – это разность потенциалов, которая возникает при  =
=  .
.
Причиной возникновения потенциала асимметрии, или «паразитного потенциала», является различие в структуре и составе внутренней и внешней поверхностей стеклянной мембраны. Этот потенциал меняется во времени, поэтому надо регулярно калибровать стеклянный электрод по буферным растворам.
§ при рН > 10 помимо основной реакции (3) начинает в заметной степени протекать побочная реакция:
Ме+(р) + Н+(ст) «Ме+(ст) + Н+(р).
В этом случае уравнение Нернста для стеклянного электрода имеет вид
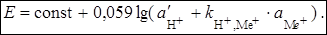
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2069; Нарушение авторских прав?; Мы поможем в написании вашей работы!