
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція №8
|
|
|
|
Кінетичні методи аналізу.
Кінетичні методи аналізу:
- Методи кількісного аналізу, які ґрунтуються на вимірюванні швидкості реакції, за величиною якої розраховують концентрацію речовини.
Аналітичним сигналом у кінетичних методах аналізу є швидкість процесу або пропорційна їй величина.
Для реакції в загальному вигляді:
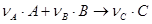 ,
,
де А і В - вихідні речовини;
С- продукт реакції;
νА, νВ, νС - стехіометричні коефіцієнти,
швидкість реакції можна визначити за зменшенням концентрації вихідної речовини у часі або за збільшенням концентрації продуктів реакції:
 .
.
Швидкість реакції залежить від багатьох чинників:
° концентрації реагуючих речовин;
° температури;
° природи розчинника;
° наявність каталізатора чи інгібітора;
° йонної сили розчину.
Тому при проведенні реакцій, за швидкістю яких визначають концентрацію певної речовини,
- дотримуються постійної температури;
- використовують високу чистоту розчинника;
- реакцію проводять за однакових умов для визначуваної речовини і контролю;
- посуд ретельно миють.
Деякі реакції (зокрема, нейтралізації), відбуваються миттєво, інші, як, наприклад,
 ,
,
за кімнатної температури протікають дуже повільно, незважаючи на їх термодинамічну вигідність. Змінюючи швидкість реакції за зміни умов її проходження, можна забезпечити вибірковість аналізу.
КМА досить прості, мають невелику вартість, універсальні, окремі реакції специфічні,наприклад, наведена нижче реакція каталізуються лише катіонами 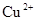 :
:
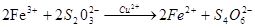 .
.
Є реакції, які каталізуються кількома каталізаторами:
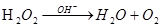 (каталізатори катіони
(каталізатори катіони 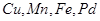 тощо),
тощо),
тому за допомогою цієї індикаторної реакції, можна визначити концентрацію кількох каталізаторів, змінюючи умови аналізу.
В КМА використовують високочутливі каталітичні методи (до 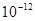 г/мл). Цим способом визначають вміст каталізаторів, спеціально вводячи їх у реакційні суміші.
г/мл). Цим способом визначають вміст каталізаторів, спеціально вводячи їх у реакційні суміші.
Каталітичні методи включають:
- не ферментативні (гомогенні), в яких використовують реакції
° окиснення – відновлення;
° хемілюмінесцентні;
° комплексоутворення;
- ферментативні
° гомогенні;
° гетерогенні (імобілізовані ферменти);
- електрохімічні (гетерогенні).
Некаталітичні реакції дають змогу визначити речовину у значних концентраціях. Їх використовують значно рідше для визначення індивідуальних речовин та аналізу сумішей (диференціальні кінетичні методи.
Диференціальні кінетичні методи дають змогу аналізувати суміші близьких за природою сполук, зокрема, одночасне виявлення 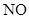 і
і 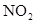 у повітрі проводять за реакцією утворення нітрозильного колчедану Fe (II):
у повітрі проводять за реакцією утворення нітрозильного колчедану Fe (II):
 ;
;
 ,
,
швидкість якої для 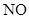 і
і 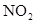 різна (
різна (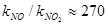 ). Визначають 8·10-4 моль (об’єм повітря великий).
). Визначають 8·10-4 моль (об’єм повітря великий).
Реакції, за швидкістю яких визначають концентрацію речовин, називаються індикаторними, а речовину, зміну концентрації якої вимірюють в ході реакції, називають індикаторною речовиною.
Індикаторна реакція повинна відповідати таким вимогам:
- швидкість повинна бути такою, щоб її можна було фіксувати ( ), проте останнім часом розробили методи, які дають змогу визначити швидкість реакцій, які відбуваються миттєво (утворення радикалів); тоді
), проте останнім часом розробили методи, які дають змогу визначити швидкість реакцій, які відбуваються миттєво (утворення радикалів); тоді 
- повинен існувати простий спосіб визначення концентрації індикаторних речовин.
- концентрація визначувальної речовини в процесі проходження індикаторної реакції практично не повинна змінюватися.
Способи вимірювання швидкості реакції:
- хімічні методи –використовуються для вимірювання швидкості повільних реакцій; якщо реакція відбувається швидко, в певний час її потрібно миттєво зупинити для відбору проби. Для зупинки реакції використовують: різке охолодження реакційної суміші; додавання реагенту, який зв’язує одну з вихідних речовин у малорозчинну сполуку, комплекс чи слабкий електроліт; додають речовину, яка утворює з каталізатором комплексну сполуку.
- інструментальні методи – вимірюють фізичну характеристику, функціонально пов’язана з концентрацією індикаторної речовини (оптичну густину, силу струму, потенціали, інтенсивність люмінісценції).
Перевагою цих методів є: можливість проводити вимірювання безпосередньо в реакційному посуді, без зупинки реакції і відбору проб. Нижче наведені різні способи вимірювання швидкості реакції інструментальними методами.
- фотометричний:
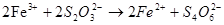 ;
;
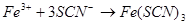 (криваво- червоний).
(криваво- червоний).
- нефелометричний:
 ;
;
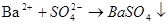 .
.
- люмінесцентний: окиснення люмінесцінюючої речовини стільбексону пероксидом водню; каталізується 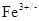 за зменшенням інтенсивності випромінювання.
за зменшенням інтенсивності випромінювання.
- потенціометричні: вимірюють зміну потенціала 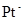 електрода
електрода 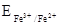 залежно від співвідношення
залежно від співвідношення 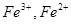 :
:
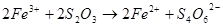 , каталізатор -
, каталізатор -  ;
;
 .
.
- вольтметричний:
 ;
;
(за струмом 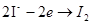 ).
).
Кінетичними методами визначають:
- суміші каталізаторів, змінюючи умови реакції;
- слідові кількості домішок (в ультра малих кількостях - 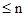 мг) у високочистих речовинах;
мг) у високочистих речовинах;
- токсиканти в об’єктах довкілля і живих організмах;
- швидкості реакції комплексоутворення і каталізу;
- константи рівноваги процесів за кінетичними даними.
Нижче наведені окремі приклади використання каталітичних і не каталітичних реакцій в аналітичній хімії.
- визначення 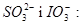
 (
(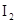 - індикаторна речовина)
- індикаторна речовина)
(за появою синього кольору комплексу йоду з крохмалем);
- визначення тіосульфатів за руйнуванням їх кислотою:
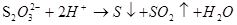 (за появою каламуті);
(за появою каламуті);
- визначення сульфат - іонів за утворенням кристалів  ; оксалатів – за утворенням
; оксалатів – за утворенням  ; хроматів – за появою
; хроматів – за появою  :
:
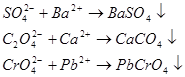 (за допомогою мікроскопа фіксують появу кристалів)
(за допомогою мікроскопа фіксують появу кристалів)
Каталітичні методи дають змогу визначити малі концентрації речовин, тому їх використовують для виявлення домішок у напівпровідниках;аналізу особливо чистих реагентів; виявлення токсичних домішок у біологічних об’єктах:
- визначення домішок  в особливо чистій нітратній кислоті:
в особливо чистій нітратній кислоті:
метилоранж у кислому середовищі окислюється  у безбарвну сполуку в присутності
у безбарвну сполуку в присутності  ;
;
- визначення каталізатора:  за реакцією руйнування
за реакцією руйнування  в лужному середовищі:
в лужному середовищі:

(за об’ємом кисню або концентрацією  );
);
· кількість  визначається йодометрично:
визначається йодометрично:

( можна визначити фотометрично у вигляді йод - крохмального комплексу, або титриметрично – титруванням розчином
можна визначити фотометрично у вигляді йод - крохмального комплексу, або титриметрично – титруванням розчином  (індикатор – крохмаль):
(індикатор – крохмаль):
 ;
;
· перманганатометрично (титруванням розчином KMnO4 в кислому середовищі до появи ледь – помітного рожевого забарвлення):
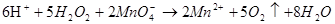
- визначення слідів катіонів  чи
чи  за хемілюмінесцентною реакцією:
за хемілюмінесцентною реакцією: 
(фіксують або інтенсивність люмінесценції або кількість виділеного світла впродовж певного часу);
- визначення ванадію за гасінням люмінесценції люмінолу з  , оскільки V утворює стійкі комплекси з
, оскільки V утворює стійкі комплекси з  ;
;
- визначення  за окисненням аміаку
за окисненням аміаку  в лужному середовищі при нагріванні:
в лужному середовищі при нагріванні:
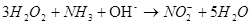 .
.
Типи індикаторних реакцій в КМА:
- реакції окиснення органічних і неорганічних сполук  ;
;
Окиснення еріохром чорного Т пероксидом водню (виявлення Mn2+): забарвлення у лужному середовищі хромоген чорний Т повільно окислюється, утворюючи сполуку жовтого кольору, яку екстрагують аліловим спиртом. Чутливість реакції 10-3 мкг/мл.
- окиснення аніонами кисневмісних кислот: 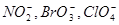 ;
;
Окиснення роданіду нітратом натрію в присутності Fe3+:  в кислому середовищі окислює SCN- з утворенням безбарвних продуктів (реакція каталізуються йодидами). Використовується для визначення йодидів у природних водах. Чутливість 10-5 мкг/мл.
в кислому середовищі окислює SCN- з утворенням безбарвних продуктів (реакція каталізуються йодидами). Використовується для визначення йодидів у природних водах. Чутливість 10-5 мкг/мл.
- окиснення і відновлення катіонами металів: окиснення Fe2+ катіонами Ag+:
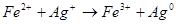 ;
;
Реакція проходить повільно; в присутності сполук золота прискорюється. Чутливість – 10-6 мкг·Ан/мл.
- окиснення за допомогою ферментів (мають високу чутливість і вибірковість)
Визначення концентрації речовини кінетичними методами:
1. Метод тангенсів (для каталітичних реакцій; індикаторною речовиною є продукт реакції, концентрацію якого позначають літерою х. Готують кілька розчинів з однаковим вмістом вихідних речовин, в які вводять різні кількості каталізатора і вимірюють швидкість реакції через певні проміжки часу, концентрацію одного з продуктів реакції (індикаторної речовини) чи будь – яку пропорційну її величину (оптичну густину, потенціал, силу дифузійного струму тощо). В один з розчинів (Со) каталізатор не вводиться. Будують графічну залежність концентрації продукта реакції від часу за різного вмісту визначу вальної речовини (Рис. 8.1).
Визначають тангенси кутів нахилу відповідних прямих і будують градуювальний графік tg =f(C). (Рис. 8.2), за яким визначають вміст визначувальної речовини в досліджуваному розчині
=f(C). (Рис. 8.2), за яким визначають вміст визначувальної речовини в досліджуваному розчині
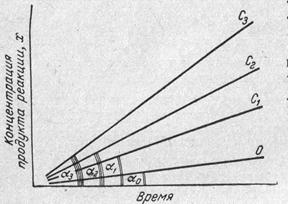
Рис. 8.1 Залежність концентрації продукта реакції від часу за різних концентраціях визначувальної речовини
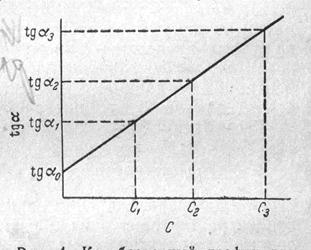
Рис. 8.2 Градуювальний графік для визначення концентрації визначувальної речовини
2. Метод фіксовальної концентрації. Реакційні суміші готують аналогічно, описаному вище;вводячи різні кількості каталізатора. Фіксують проміжок часу, коли концентрація індикаторної речовини досягає певного значення,
Через проміжок часу, коли концентрація індикаторних речовини досягає певного значення (найпростіше, певної оптичної густини), або реагуючих речовин (рис. 8.3). визначають час впродовж якого за різних концентрацій визначувальної речовини досягається одна й та ж концентрація індикаторної речовини. Будують графік 1/τ = f (C) градуювальник (Рис. 8.4).

Рис. 8.3 Залежність концентрації індикаторної речовини від часу
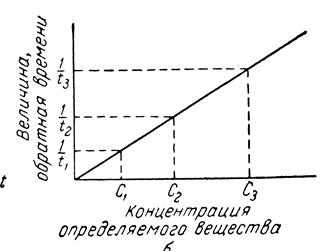
Рис. 8.4 Градуювальний графік для визначення концентрації визначувальної речовини
3. Метод фіксованого часу – реакцію зупиняють через певний проміжок часу і визначають концентрацію індикаторної речовини.
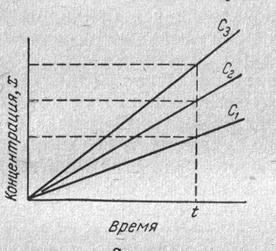
Рис. 8.4 Залежність різних концентрації продукту реакції від фіксованого часу

Рис. 8.5 Градуювальний графік для визначення концентрації визначувальної речовини
Кінетичні методи, завдяки високій чутливості, селективності, можливості визначення кількох споріднених речовин, широко застосовується в екологічних дослідженнях, біології, медицині, фармакології, агрохімії, аналізі хімічних реагентів, особливо чистих речовин, продуктів.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1303; Нарушение авторских прав?; Мы поможем в написании вашей работы!