
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перманганатометрия
|
|
|
|
Краткая характеристика конкретных методов
окислительно ‑ восстановительного титрования.
Известно огромное количество окислителей и восстановителей, но лишь немногие из них по ряду причин могут быть использованы в редоксметрии. К ним относятся KMnO4, K2Cr2O7, KBrO3, KCIO3, церий (IV), I2 и некоторые другие.
В таблице 8 [1] представлены соответствующие методы окислительно - восстановительного титрования. Мы рассмотрим принципы и некоторые примеры конкретных наиболее широко применяемых окислительно – восстановительных методов.
В основе перманганатометрии лежат реакции перманганат ─ иона. Окислительные свойства KMnO4 зависят от среды, в которой протекает реакция:
в сильнокислой среде 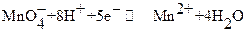
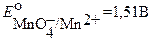 ;
;
при рН 5 − 8 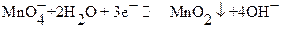
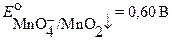 ;
;
при pH >9 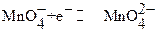
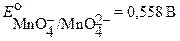
Подавляющее большинство перманганатометрических титрований проводят в сильнокислой среде (pH < 1). При этом 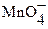 в несколько последовательных стадий восстанавливается до
в несколько последовательных стадий восстанавливается до 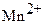 . Заметно реже титрование проводят в слабокислых (pH > 4), нейтральных или слабощелочных растворах. Перманганатометрически в щелочной среде определяют, как правило, органические соединения, например, муравьиную, винную, лимонную, поли – и оксикарбоновые кислоты, альдегиды, ацетон, гидразин и т.д.
. Заметно реже титрование проводят в слабокислых (pH > 4), нейтральных или слабощелочных растворах. Перманганатометрически в щелочной среде определяют, как правило, органические соединения, например, муравьиную, винную, лимонную, поли – и оксикарбоновые кислоты, альдегиды, ацетон, гидразин и т.д.
Приготовление и стандартизация растворов KMnO4.
Стандартные растворы KMnO4 не могут быть приготовлены исходя из точной навески этой соли, так как она содержит ряд примесей, которые при растворении восстанавливают часть KMnO4. Стандартизацию растворов KMnO4 проводят обычно по точной навеске чистой соли Na2C2O4, которую растворяют в H2SO4 и полученный раствор щавелевой кислоты титруют раствором KMnO4:
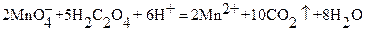
Механизм реакции сложен. Поэтому воспроизводимые результаты получают только тогда, когда выполняются определенные эмпирические условия (см. конкретные методики). Очень большую роль играет температура; обычно титрование проводят в растворах, температура которых около 70°С. В этих условиях скорость реакции достаточно велика. Конечную точку титрования определяют по появлению бледно-розовой окраски раствора, не исчезающей в течение нескольких секунд. Интенсивная окраска перманганат ‑ ионов осложняет измерение объема реагента в бюретке. На практике обычно отсчет ведут по поверхности раствора, а не по нижней части мениска жидкости. При титровании очень разбавленными растворами KMnO4 в качестве индикаторов применяют дифениламин, фенилантраниловую кислоту или ферроин.
Определяемые вещества.
Перманганатометрическим титрованием можно количественно определять восстановители, окислители, а также косвенно вещества, не обладающие ни окислительными, ни восстановительными свойствами, но способные взаимодействовать с окислителями или восстановителями с образованием стехиометрических соединений, например, мало растворимых соединений.
Прямым перманганатометрическим титрованием определяют следующие восстановители:
1. ряд ионов металлов, восстановленных предварительно до низших степеней окисления: Fe(II), Cu(I), Sn(II), As(III), Ce(III), Cr(II), Ti(III), U(IV), Mo(III), V(IV) и т.д.;
2. кислоты, анионы которых обладают восстановительными свойствами, и их соли: H2C2O4, HAsO2, H2SO3, H2S, HNO2, HI, HBr, HSCN;
3. другие восстановители: тиосульфаты, H2O2 и т.д.
При титровании ионов металлов типа Fe2+,Cu+ n (Ме) = n (1/5 KMnO4); отсюда:
m (Me) = M (Me) c (1/5 KMnO4) V (KMnO4); в случае же переходов типа Me(III)®Me(V):
m (Me) = M (1/2 Me) c (1/5 KMnO4) V (KMnO4).
Обратным титрованием определяют окислители. Для этого к отмеренному объему раствора анализируемого вещества, прибавляют отмеренный объем стандартного раствора восстановителя (часто – Fe(II)), взятый в избытке, а затем этот избыток титруют стандартным раствором KMnO4.
Примером может служить определение бихромат ‑ ионов, основанное на их восстановлении ионами Fe2+ c последующим титрованием остаточного количества соли двухвалентного железа стандартным раствором KMnO4:
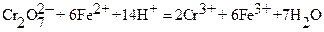

Исходя из принципа эквивалентности, схема количественного расчета следующая:
n (Fe)

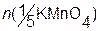
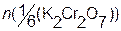
Откуда: 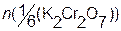 = n (Fe)
= n (Fe) 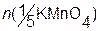
Косвенным титрованием (титрованием заместителя) определяют ионы: Ca2+, Mg2+, Ba2+, Zn2+, Pb2+, Sn2+, Co2+, Ln3+, Th4+. Метод основан на осаждении оксалатов перечисленных металлов; промывании, растворении осадков в 2 М H2SO4 и титровании освобождающейся щавелевой кислоты (заместителя) при 70°С. Принципиальная схема количественного расчета: 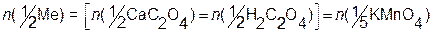
Классические примеры практического применения перманганатометрии.
Определение содержания железа (в рудах, сплавах и солях).
Метод основан на оксидиметрическом титровании ионов Fe2+ стандартным раствором KMnO4:
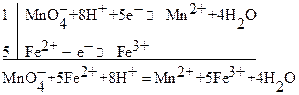
После соответствующего растворения анализируемого объекта железо, как правило, оказывается в трехвалентном состоянии в солянокислой среде. Переведение его в двухвалентное состояние может осуществляться различными способами. Обычно для этого солянокислый анализируемый раствор медленно пропускают через
стеклянную колонку ‑ редуктор, заполненную гранулами амальгамированного цинка или висмута. При этом ионы 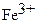 количественно восстанавливаются до Fe2+:
количественно восстанавливаются до Fe2+:
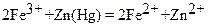

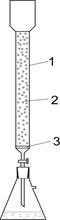
Рисунок – Редуктор Джонса.
1- стеклянная трубка; 2 ─ гранулированные металлический цинк или амальгамированный цинк или металлический висмут; 3 ─ фарфоровая пластинка с отверстиями, на которой находится слой стеклянной ваты.
Серьезная проблема заключается в том, что при титровании 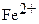 в соляной кислоте может возникнуть значительная положительная ошибка, т.к. наряду с основной реакцией:
в соляной кислоте может возникнуть значительная положительная ошибка, т.к. наряду с основной реакцией:
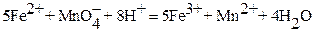
будет протекать сопряженная реакция:
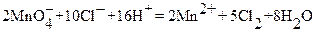 ,
,
индуцированная и катализируемая образующимися ионами 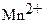 . В результате увеличивается расход
. В результате увеличивается расход 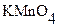 и будет получен неправильный результат анализа.
и будет получен неправильный результат анализа.
Механизм индуцирования сложен, но предполагают, что восстановление перманганат ‑ иона идет ступенчато с образованием трехвалентного марганца, который и окисляет хлорид ‑ ион. Для устранения этого источника ошибок предложены два приема:
а) удаление HCl перед титрованием выпариванием раствора с H2SO4 и
б) добавление защитной смеси (реагента Циммермана‑Рейнгарда) с последующим титрованием в присутствии HCl. Реагент Циммермана‑Рейнгарда представляет собой смесь растворов MnSO4, H3PO4 и H2SO4. Введение избытка Mn2+ и H3PO4 устраняет индуцированную реакцию, предположительно за счет снижения редокспотенциала системы Mn(III)/Mn(II) в результате образования комплекса Mn(III) с фосфорной кислотойю. Фосфорная кислота образует с ионами железа (III) бесцветное комплексное соединение:
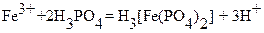 ,
,
в результате чего устраняется желтый цвет раствора, обусловленный ионами 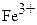 , и КТТ четко фиксируется по появлению бледно − розовой окраски от малейшего избытка
, и КТТ четко фиксируется по появлению бледно − розовой окраски от малейшего избытка 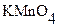 .
.
Определение содержания кальция (в известняке).
Метод основан на перманганатометрическом титровании заместителя – щавелевой кислоты. Точную навеску порошкообразного известняка растворяют в хлороводородной кислоте:
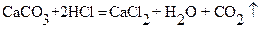
Затем при тщательно подобранных условиях кальций осаждают в виде моногидрата оксалата кальция:
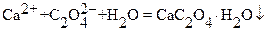
Осадок отделяют от маточного раствора и от избытка оксалата фильтрованием. Далее осадок растворяют в серной кислоте:
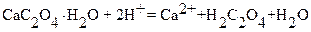
и образующуюся щавелевую кислоту титруют стандартным раствором KMnO4. Хотя ион кальция и не принимает участие в окончательном титровании, он стехиометрически связан с количеством титруемой щавелевой кислоты. Вследствие этого можно записать уравнение материального баланса в виде:
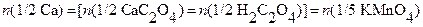 .
.
Отсюда:
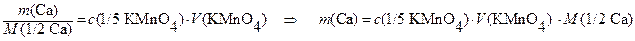
Иодометрия ( краткие сведения)
Особое место среди редоксметрических методов титрования занимает иодометрический метод, основанный на определении количества иода, которое затрачивается на окисление восстановителей или выделяется при взаимодействии окислителя с раствором иодида калия. Реакция окисления ─ восстановления с участием иода обратима, то есть в зависимости от условий она может протекать в прямом или обратном направлении:
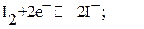
Иод очень мало растворим в воде. Поэтому титрант, называемый иодом, в действительности представляет собой раствор иодида калия, в котором растворено необходимое количество кристаллического иода. При этом образуется комплексный трииодид ион: 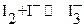
и более корректно следует записывать:
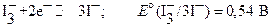
Независимость приведенных полуреакций от кислотности раствора представляет важную особенность иодометрических определений. Окислительно ─ восстановительный потенциал системы 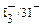 не зависит от рН раствора. Это позволяет проводить иодометрические определения в широком интервале кислотности раствора (рН 2 ─ <10) и, следовательно, определение значительно более широкого круга объектов, чем другими методами титриметрического анализа. Другое достоинство метода заключается в высокой точности установления точки эквивалентности, которая фиксируется, как правило, по появлению или исчезновению синей окраски иодкрахмального комплекса или реже желтой окраски иода.
не зависит от рН раствора. Это позволяет проводить иодометрические определения в широком интервале кислотности раствора (рН 2 ─ <10) и, следовательно, определение значительно более широкого круга объектов, чем другими методами титриметрического анализа. Другое достоинство метода заключается в высокой точности установления точки эквивалентности, которая фиксируется, как правило, по появлению или исчезновению синей окраски иодкрахмального комплекса или реже желтой окраски иода.
Поскольку значения E° для обеих вышеприведенных редокспар различаются незначительно, то для удобства записи уравнений и подбора стехиометрических коэффициентов в химических уравнениях обычно пользуются первой полуреакцией.
Иод сравнительно слабый окислитель, а иодид ион сравнительно слабый восстановитель. Стандартные потенциалы многих восстановителей 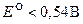 , а многих окислителей
, а многих окислителей 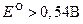 . Поэтому окислительно ─ восстановительные реакции с использованием приведенной полуреакции применяют как для определения восстановителей (титрант – стандартный раствор иода и метод иногда называют иодиметрией), так и окислителей косвенным методом.
. Поэтому окислительно ─ восстановительные реакции с использованием приведенной полуреакции применяют как для определения восстановителей (титрант – стандартный раствор иода и метод иногда называют иодиметрией), так и окислителей косвенным методом.
Иод является сравнительно мягким окислителем. Он может реагировать только с веществами, которые легко окисляются, то есть для которых значения стандартного (точнее – реального) редокс - потенциала меньше значения редокс - потенциала пары иод/трииодид‑ион. Поэтому число оксидиметрических методик в иодиметрии невелико. Прямым титрованием стандартным раствором иода количественно определяют: Sb(III), As(III), Sn(II), H2SO3, H2S, N2H4 и тиосульфаты. Обратным титрованием количественно определяют Cd2+ и Zn2+. При этом осаждают CdS или ZnS, растворяют их в 3М HCl, содержащий известный избыток стандартного раствора I2. Непрореагировавший иод оттитровывают стандартным раствором Na2S2O3.
Значительное большее значение в иодометрии имеет определение окислителей. В принципе иодид ‑ ионы способны восстанавливать окислители со стандартным редокспотенциалом, большим редокспотенциала пары трииодид/иодид ‑ ион (пары I2/2I– или I3–/3I–). Однако прямое титрование таких окислителей невозможно ввиду невозможности фиксации (индикации) КТТ. Поэтому в иодометрии для количественного определения окислителей и ионов металлов, образующих с окислителями малорастворимые соединения, применяют косвенный иодометрический метод (метод титрования заместителя). При определении окислителей стандартным раствором служит раствор тиосульфата натрия. Определяемые окислители количественно превращают иодид в свободный иод. Так как между исходным количеством окислителя и количеством образующегося иода существует стехиометрическое соотношение, то по результатам титрования иода стандартным раствором тиосульфата натрия можно рассчитать количество окислителя. Суть и схема определения сводятся к следующему:к подкисленному раствору окислителя прибавляют избыток сухого KI. Из него окислитель вытесняет эквивалентное количество свободного иода, который затем оттитровывают стандартным раствором тиосульфата натрия:
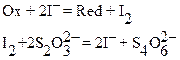
Избыток KI необходим для растворения выделяющегося I2 и уменьшения его улетучивания. Индикатором служит раствор крахмала, образующий с иодом синий иодкрахмальный комплекс, который в КТТ обесцвечивается.
Иодометрические определения обеспечивает правильные результаты анализа при соблюдении определенных условий титрования. Важнейшими из них являются температура и pH титруемого раствора. Наиболее правильные результаты получаются при титрованиях в средах, близких к нейтральной. В сильнокислых средах наряду с основной реакцией с окислителем протекает сопряженная реакция:
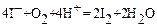 ,
,
в результате которой появляется положительная ошибка анализа, за счет выделения дополнительного количества иода. В щелочной среде (pH 8‑11) возникает побочный процесс образования аниона йодноватистой или йодноватой кислот:
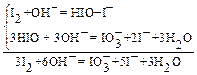
что приводит к отрицательной ошибке анализа из ‑ за потери части иода.
Приготовление и стандартизация растворов в иодометрии.
Стандартные растворы иода можно готовить непосредственно растворением тщательно взвешенной навески чистого сухого кристаллического иода (который, при необходимости, можно дополнительно очистить возгонкой) в определенном объеме раствора иодистого калия. Однако поскольку давление паров иода высоко (~0.31 мм рт.ст. при комнатной температуре), то необходимы специальные меры для предотвращения потерь иода на всех стадиях. Поэтому проще и предпочтительнее приготовление раствора иода приблизительной концентрации с последующей стандартизацией его по точной навеске чистого оксида мышьяка, растворенного в растворе гидроксида натрия с доведением pH раствора до 7÷8 последовательной нейтрализацией его соляной кислотой и добавлением бикарбоната натрия. Соответствующая реакция записывается в виде:
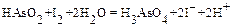
Влияние pH на смещение этого равновесия подробно рассмотрено нами ранее.
Растворы иода мало устойчивы при хранении, и их необходимо стандартизировать каждые несколько дней.
Стандартные растворы тиосульфата натрия не могут быть приготовлены по точной навеске Na2S2O3·5H2O, поскольку сначала их концентрация неустойчива во времени и стабилизируется лишь через 1‑2 недели.
Первичными стандартными веществами для стандартизации растворов тиосульфата служат окислители, выделяющие при взаимодействии с избытком иодид - ионов известное количество иода. В качестве таких окислителей чаще всего применяются K2Cr2O7 или KIO3:
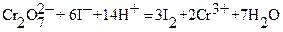
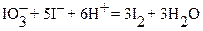
Выделившееся количество иода, эквивалентное (стехиометричное) количеству K2Cr2O7, оттитровывают раствором Na2S2O3:
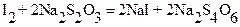
Тогда 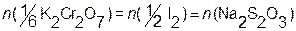 ;
;
откуда 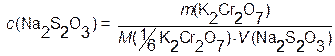
Индикатором является раствор крахмала, иодкрахмальный комплекс которого обесцвечивается в КТТ.
Косвенным иодометрическим методом можно количественно определять очень многие вещества: IO4–, IO3–, BrO3–, Br2, Cl2, HClO, O3, O2, H2O2, MnO4–, MnO2, PbO2, Cr2O72–, CrO42–, S2O82–, [Fe(CN)6]3–, As(V) и Sb(V) в 5М HCl, Ce(IV), Pb2+, Ba2+, Sr2+ (осаждением MeCrO4, растворением отмытого осадка в 1М HClO4 и титрованием полученных ионов Cr2O72–), Cu(II) и др.
Примеры определения некоторых соединений иодометрическим методом приведены в таблице 9 [1].
Принципы количественных расчетов можно рассмотреть на примере определения
m (K2Cr2O7):
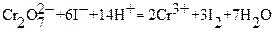 ;
; 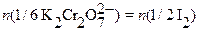
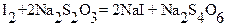 ;
; 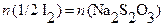
Откуда: 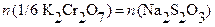 и
и
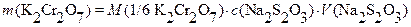
Заместительным и обратным иодометрическим титрованием возможно определение Pb2+, Ba2+, Sr2+, образующих малорастворимые осадки MeCrO4. При заместительном титровании осадки растворяют в подходящей кислоте, к раствору добавляют избыток сухого KI и выделившийся иод оттитровывают стандартным раствором тиосульфата натрия в присутствии крахмала в качестве индикатора. Схемы последовательных реакций и расчетных уравнений следующие:
Me2+→MeCrO4; 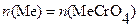
2MeCrO4+ 2H+ = 2Me2+ + Cr2O72─ + H2O; 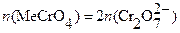
Cr2O72─ + 6I─ + 14H+ = 2Cr3+ + 3I2 + 7H2O; 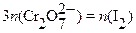
I2 + 2Na2S2O3 = 2NaI + Na2S4O6;
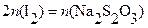
В молекулярной форме, исходя из условий материального баланса, получаем расчетное уравнение:
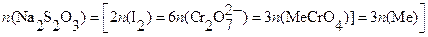
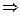
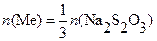
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 7845; Нарушение авторских прав?; Мы поможем в написании вашей работы!