
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
C.( №1578) – пример № 3 с.13,14
|
|
|
|
Подробнее см Калинкин И.П. Титриметрические методы анализа. Примеры решения задач. Учебное пособие:[Текст] / И.П. Калинкин, Т.Э. Маметнабиев - СПб.: СПбГТИ (ТУ), 2009. - 43 c.(№1578) – пример 42
Определение указанных металлов обратным титрованием проводится по следующей схеме. К анализируемому раствору, содержащему катион, добавляется строго измеренный избыточный объем стандартного раствора дихромата калия. Осадок отфильтровывают, к фильтрату добавляют сухой KI и выделившийся иод оттитровывают стандартным раствором тиосульфата натрия. Химические реакции и схемы количественных расчетов в молекулярной и эквивалентной формах см.:
Калинкин И.П. Титриметрические методы анализа. Примеры решения задач. Учебное пособие:[Текст] / И.П. Калинкин, Т.Э. Маметнабиев - СПб.: СПбГТИ (ТУ), 2009. –
Последней задачей в практикуме химических методов анализа является иодометрическое определение меди в растворах, которое основано на реакции, рассмотренной в предыдущей лекции:

Иод, выделившийся в количестве, эквивалентном количеству меди, оттитровывают стандартным раствором тиосульфата в присутствии крахмала в качестве индикатора. КТТ определяют по обесцвечиванию раствора иодкрахмального комплекса.
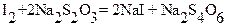
При этом 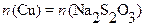 ,
, 
Ион водорода не принимает участия в реакции, однако значение pH влияет на скорость процесса, а также на правильность определения из ‑ за возможных побочных процессов гидролиза (образования гидроксокомплексов меди при pH > 4) и инду–цированного окисления иодида калия кислородом воздуха (при [H+] > 0,3 моль·л–1).
Источником существенной отрицательной ошибки результатов титрования является адсорбция иода (корректнее – трииодид ‑ иона) осадком CuI. Трииодид ‑ ион настолько прочно удерживается поверхностью осадка, что реакция между тиосульфатом и трииодидом (иодом) не проходит до конца. Это можно избежать, если в раствор при приближении КТТ добавить небольшой избыток тиоцианата калия. При этом на поверхности выпавшего осадка будет протекать реакция обмена:
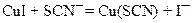
За счет меньшей растворимости осадка Cu(SCN), он практически не адсорбирует трииодид ион. Однако тиоцианат нельзя добавлять в раствор в начале титрования, так как трииодид ион медленно окисляет его.
Иодометрическое определение кислот см. Калинкин И.П. Титриметрические методы анализа. Примеры решения задач. Учебное пособие:[Текст] / И.П. Калинкин, Т.Э. Маметнабиев - СПб.: СПбГТИ (ТУ), 2009. – 43 c.(№1578) –Раздел 2.7 с. 36, 37.
Дихроматометрия (хроматометрия, бихроматометрия). В основе дихроматометрии лежат реакции окисления дихроматом калия в кислой среде:
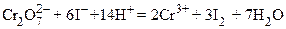
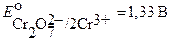
Сопоставление величин стандартных окислительно – восстановительных потенциалов перманганата калия и дихромата калия показывает, что последний является менее сильным окислителем и поэтому он менее широко применяется. В отличие от перманганатометрии титрования можно проводить в солянокислой среде. При этом Cl─ ионы не окисляются, т.к.  практически равен потенциалу пары
практически равен потенциалу пары 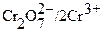 . Однако при концентрациях HCl больше, чем 2 моль∙л─1, а также при кипячении бихромат окисляет Cl─ ионы до Cl2
. Однако при концентрациях HCl больше, чем 2 моль∙л─1, а также при кипячении бихромат окисляет Cl─ ионы до Cl2
Стандартный раствор K2Cr2O7 готовят по точной навеске поскольку препарат отвечает всем требованиям, предъявляемым к первичным стандартам.
Наиболее важным практическим применением дихроматометрии является определение железа в рудах, шлаках, сплавах, сталях и т.д., которое, после растворения анализируемых объектов, восстанавливают до Fe2+ (как и в перманганатометрии) и титруют стандартным раствором K2Cr2O7.
В ТЭ  откуда масса
откуда масса  (в г):
(в г): 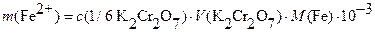 или
или  ,
,
Реакция титрования железа(II) является заключительным этапом различных аналитических методик, основанных на реакциях взаимодействия Fe(III) или Fe(II) с определяемым веществом. Например, хром в сталях окисляют до Cr2O72─, добавляют избыток стандартного раствора соли Мора  и остаток соли оттитровывают стандартным раствором дихромата калия (способ обратного титрования).
и остаток соли оттитровывают стандартным раствором дихромата калия (способ обратного титрования).
Индикатором обычно служит дифениламин (см. табл.); титрование Fe2+ необходимо проводить в присутствии H3PO4, связывающей образующиеся при реакции Fe3+ ─ ионы в бесцветный комплекс 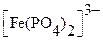 и тем самым понижающей окислительно – восстановительный потенциал этой редокс – пары. Только в этом случае изменение окраски индикатора происходит в пределах скачка потенциала на кривой титрования.
и тем самым понижающей окислительно – восстановительный потенциал этой редокс – пары. Только в этом случае изменение окраски индикатора происходит в пределах скачка потенциала на кривой титрования.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1350; Нарушение авторских прав?; Мы поможем в написании вашей работы!