
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика негіздері
|
|
|
|
2.8.1 Еркіндік дәрежесі туралы ұғым. Энергияның еркіндік дәреже бойынша бөлініп таралу заңы
Молекулалардың ілгерілемелі қозғалысының орташа кинетикалық энергиясы
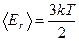 (2.8.1.1)
(2.8.1.1)
формуласымен анықталады.
Идеал газ молекулаларының ретсіз қозғалысының кинетикалық энергиясы оның ішкі энергиясын құрайды. Себебі идеал газдың молекулаларының әсерлері тек бір-біріне соқтыққанда ғана көрінеді. Ал нақты газдың ішкі энергиясын молекулалардың қозғалысының кинетикалық энергиясы мен олардың бір-бірімен әсерлесуінің потенциалдық энергиясы құрайды. Газ молекулаларының қозғалысының кинетикалық энергиясы олардың ілгерілемелі, айналмалы және тербелмелі қозғалыстарының кинетикалық энергияларынан тұрады.
Молекулалардың қозғалысының әр түріне келетін энергияларды білу үшін еркіндік дәрежесі туралы ұғым енгізу керек.
Еркіндік дәрежесі деп дененің кеңістіктегі орнын анықтайтын тәуелсіз координаталардың санын айтады.
Мысал үшін, кеңістікте қозғалған материялық нүктенің үш еркіндік дәрежесі бар. Өйткені оның кеңістіктегі орнын анықтау үшін үш координата 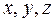 керек.
керек.
Газдың әрбір молекуласының белгілі еркіндік дәрежесі бар. Оның үшеуі ілгерлемелі қозғалысқа сәйкес келеді. Молекулалар қозғалысының ретсіздігі оның ілгерлемелі қозғалысына ғана емес, сонымен бірге айналмалы, тербелмелі қозғалысына да қатысты.
Молекулалардың еркiндiк дәрежесiне энергия бiрдей мөлшерде бөлiнедi. Ендеше бiр еркiндiк дәрежеге келетiн энергияны шығарып алу оңай. (2.8.1.1) формуласы молекуланың iлгерлемелi қозғалысын анықтаса және iлгерілемелi қозғалыс үшiн еркiндiк дәреже саны үшеу болса, бiр еркiндiк дәрежеге келетін энергия  болады. Егер еркiндiк дәреже саны
болады. Егер еркiндiк дәреже саны  -ге тең болса, бiр молекуланың барлық қозғалыс үшiн кинетикалық энергиясы
-ге тең болса, бiр молекуланың барлық қозғалыс үшiн кинетикалық энергиясы
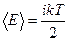 (2.8.1.2)
(2.8.1.2)
болады.
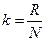 екендігін ескеріп бір мөл идеал газдың ішкі энергиясы үшін
екендігін ескеріп бір мөл идеал газдың ішкі энергиясы үшін
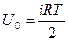 (2.8.1.3)
(2.8.1.3)
деп жазамыз.
Кез келген массалы идеал газ үшін ішкі энергия
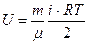 (2.8.1.4)
(2.8.1.4)
Бір атомды газ молекуласын шар деп алып және ол айналмайды десек, оның еркіндік дәреже саны үшеу болды.
Екі атомды газ үшін олар шар тәрізді және бір-бірімен арасы өзгермейтін байланыста десек, онда еркіндік дәреже саны бесеу болады (үшеуі ілгерлемелі қозғалыс, екеуі айналмалы қозғалыс үшін).
2.8.2 Термодинамиканың бірінші заңы
Термодинамикада көптеген тәжірибелер нәтижесінде анықталған ақиқаттардың ең сенімділері таңдалып алынады да логикалық қорытындылар арқылы дербес заңдар белгіленеді. Термодинамика дербес ғылым ретінде өзінің екі заңы анықталғаннан кейін пайда болды.
1-ші заңы: энергияның пайда болуы және жойылуы мүмкін емес.
2-ші заңы: нәтижесі тек жылудың жұмысқа айналуы болатын периодты процесс болмайды.
Жүйенің сырқы ортадан қабылдаған 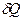 жылуы сыртқы күштерге қарсы істелінген жұмысқа және жүйенің ішкі энергиясын өсіруге жұмсалады:
жылуы сыртқы күштерге қарсы істелінген жұмысқа және жүйенің ішкі энергиясын өсіруге жұмсалады:
дQ=dU +дA (2.8.2.1)
мұндағы дQ – жүйеге берілетін жылу, 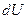 - ішкі энергияның өзгерісі, дA-жүйенің істейтін жұмысы.
- ішкі энергияның өзгерісі, дA-жүйенің істейтін жұмысы.
Егер жүйеге дQ жылу берілсе және сыртқы күштер жұмыс істесе, онда термодинамиканың бірінше заңы былай жазылады:
 (2.8.2.2)
(2.8.2.2)
 - сыртқы күштердің жүйеге қарсы істейтін жұмысы.
- сыртқы күштердің жүйеге қарсы істейтін жұмысы.
Жылу және жұмыс - энергияның берілу түрі - процесс, ал ішкі энергия күй функциясы болып табылады. dU – толық дифференциал, ал дQ мен дА толық дифференциал емес.
2.8.3 Көлемі өзгергенде газдың істейтін жұмысы
Цилиндрде поршень астында газ бар болсын. (2.8.3.1 – сурет)

2.8.3.1-сурет
Егер газ ұлғая отырып поршенді  биіктікте көтерсе, онда газдың істейтін жұмысы:
биіктікте көтерсе, онда газдың істейтін жұмысы:
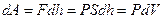 (2.8.3.1)
(2.8.3.1)
болады, 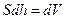 - газ көлемінің өзгерісі, S – поршеннің табанының ауданы.
- газ көлемінің өзгерісі, S – поршеннің табанының ауданы.
Осы кездегі газдың істейтін толық жұмысы мынадай:
 (2.8.3.2)
(2.8.3.2)

2.8.3.2-сурет
Газ жұмысының графигі (2.8.3.2)-суретте берілген. Жұмыс 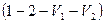 фигурасының ауданы арқылы анықталады.
фигурасының ауданы арқылы анықталады.
2.8.4 Газдардың жылу сыйымдылығы. Майер теңдеуі
Заттың жылу сыйымдылығы деп сол заттың температурасын бір градусқа көтеруге қажетті жылу мөлшерін айтады:
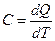 (2.8.4.1)
(2.8.4.1)
Заттардың меншікті жылу сыйымдылығы деп 1 кг заттың температурасын 1 градусқа көтеруге керекті жылу мөлшерін айтады:
 ; (2.8.4.2)
; (2.8.4.2)
Молярлық жылу сыйымдылық деп 1 моль газдың температурасын бір градусқа көтеруге кеткен жылу мөлшерін айтады:
 (2.8.4.3)
(2.8.4.3)
мұндағы 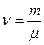 – мөл саны,
– мөл саны, 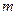 – газ массасы, м – молярлық масса. Молярлық жылу сыйымдылықтың өлшем бірлігі:
– газ массасы, м – молярлық масса. Молярлық жылу сыйымдылықтың өлшем бірлігі: 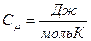 .
.
Молярлық жылу сыйымдылық пен меншікті жылу сыйымдылықтың байланысы төмендегідей:
 (2.8.4.4)
(2.8.4.4)
Газдардың жылу сыйымдылығы тұрақты қысымдағы жылу сыйымдылық және тұрақты көлемдегі жылу сыйымдылық болып бөлінеді.
Газды тұрақты көлемде қыздырған жағдайда
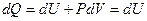
жүйеге берілген жылу түгелдей ішкі энергияны арттыруға жұмсалады.
Бір моль газ үшін тұрақты көлемдегі молярлық жылу сыйымдылық  (2.8.4.5)
(2.8.4.5)
болады. (2.8.1.3) формула бойынша
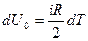 ,
,
ендеше
 (2.8.4.6)
(2.8.4.6)
болады.
Газды тұрақты қысымда қыздырған жағдайда бір моль газ үшін термодинамиканың бірінші заңы:
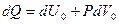
мұндағы 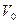 - 1 моль газдың көлемі.
- 1 моль газдың көлемі.
Ал тұрақты қысымдағы молярлық жылу сыйымдылық
 (2.8.4.7)
(2.8.4.7)
болады.
Менделеев-Клапейрон теңдеуін қолданып:

немесе бұл формуланы төмендегідей жазуға болады:
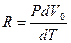 (2.8.4.8)
(2.8.4.8)
(2.8.4.7) формуласына (2.8.4.5) мен (2.8.4.8)-ді қойғанда:
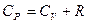 (2.8.4.9)
(2.8.4.9)
Бұл Майер теңдеуі делінеді.
(2.8.4.6) формуласын (2.8.4.9)-ға қойсақ:
 (2.8.4.10)
(2.8.4.10)
шығады.
Сонда  - ның
- ның 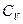 -ға қатынасы мынаған тең:
-ға қатынасы мынаған тең:
 (2.8.4.11)
(2.8.4.11)
2.8.5 Идеал газдардың жылу сыйымдылығының классикалық теориясы
Бір атомды газдар үшін еркіндік дәрежесі і=3 болады, сондықтан:
 ,
,  ,
,  .
.
Екі атомды газдар үшін і=5, онда:
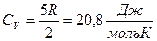 ,
,  ,
,  .
.
Үш атомды газдар үшін i=6, онда:

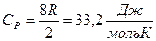 ,
, 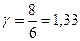 .
.
Кейбір газдар үшін Cv, Cp, г –нің эксперименттік мәндері 3-кестеде көрсетілген.
3-кесте
| Газ | Cv | Cp | 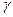
|
| H2 | 12,5 | 20,9 | 1,67 |
| O2 | 20,9 | 28,9 | 1,40 |
| CO | 21,0 | 39,3 | 1,40 |
| Су буы | 27,6 | 36,2 | 1,31 |
Бір және екі атомды газдар үшін эксперимент нәтижелері мен теория үйлеседі. Ал, үш атомды газдар үшін эксперимент нәтижелері мен теория арасында алшақтық бар. Күрделі молекулалардың (еркіндік дәреже саны алтыдан көп болатын газдарда) жылу сыйымдылықтарын есептеуде классикалық теорияны пайдалануға болмайды.

2.8.5.1 – сурет
Классикалық теория бойынша идеал газдардың жылу сыйымдылығы температураға байланыссыз. Ал тәжірибелер жылу сыйымдылықтың температураға байланысты екенін көрсетеді. Сутегінің жылу сыйымдылығының температураға байланыстылығы (2.8.5.1) -суретте көрсетілген.
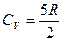 тек орташа температураларда ғана орындалады. Жоғарғы температураларда (Т>2000К)
тек орташа температураларда ғана орындалады. Жоғарғы температураларда (Т>2000К)  болады. Ал төменгі температураларда (Т<50K)
болады. Ал төменгі температураларда (Т<50K)  , яғни төменгі температурада екі атомды газдың жылу сыйымдылығы бір атомды газдың жылу сыйымдылығына ұмтылады:
, яғни төменгі температурада екі атомды газдың жылу сыйымдылығы бір атомды газдың жылу сыйымдылығына ұмтылады:
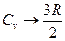
Мұндай жағдайды кванттық теория түсіндіреді. Егер атомдарды тербелуші бөлшек (осциллятор) деп қарастырсақ, онда оның энергиясы классикалық теория бойынша үздіксіз өзгереді, ал кванттық теория бойынша секірмелі түрде өзгереді.
Осциллятор энергиясы Энштейн бойынша мынадай формуламен өрнектеледі:
 (2.8.5.1)
(2.8.5.1)
Екі атомды газдың ішкі энергиясы:
 (2.8.5.2)
(2.8.5.2)
а) hн<<kT болған кезде
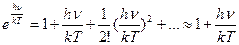 (2.8.5.3)
(2.8.5.3)
онда (2.8.5.2) - тің екінші қосылғышы (2.8.5.3) –ні ескерген жағдайда
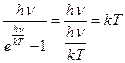
болады.
Ал, газдың ішкі энергиясы
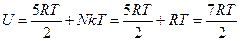 .
.
онда

болады.
б) hн>>kT болғанда

ендеше
 ,
, 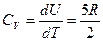
формулалармен анықталады.
Температура әрі қарай төмендегенде молекулалардың айналмалы қозғалысының еркіндік дәрежесі болмайды, яғни 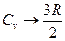 .
.
Есеп мысалдары
1.Атмосфералық қысымда және 00С температурада сутегі молекуласының еркін жол жүру ұзындығы 13 мкм. Сутегі молекуласының диаметрін анықта.
2. 1 секунд ішінде 1см3 ауада азот молекулалары бір-бірімен және азот молекулалары оттегі молекулаларымен қанша рет соқтығысатынын анықтау керек.
3. Идеал газды тұрақты қысымда қыздырған. Температураға байланысты бірлік уақыт ішінде жеке молекуланың еркін жол ұзындығы мен соқтығысу саны қалай өзгереді?
4. Газ изотермалық сығылады. Молекуланың еркін жол ұзындығы мен соқтығысу саны арасындағы байланысты анықта.
5.Бір көлемде екі газдың қоспасы бар. Ондағы бірінші газдың концентрациясы n1, екінші газдың концентрациясы n2, радиустары сәйкес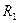 және
және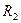 . Осы газдардың молекулаларының еркіндік жол ұзындығын анықта.
. Осы газдардың молекулаларының еркіндік жол ұзындығын анықта.
6.Молекуласының ілгерілемелі қозғалысының орташа ктнетикалық энергиясы 1,6*10-19 Дж болса, газдың температурасы қандай?
7. Молекулаларының концентрациясы 1019см-3 болатын идеал газдың қысымын анықтау керек. Газ температурасы 1000К.
8. Газдың молекулаларының орташа квадраттық жылдамдығы 600м/м болса, олардың орташа арифметикалық жылдамдығы қандай?
9. Көлемі 10-3м3 болатын колбадағы 1,5*10-4кг сутегінің қысымы 2*10-5Н/м2. Молекулалардың орташа квадраттық жылдамдықтары қандай?
2.9 Термодинамиканың 1-ші заңын изопроцесстерге қолдану
1) Газ бір күйден келесі бір күйге тұрақты көлемде өтетін изохоралық процесс кезінде 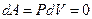 болғандықтан, термодинамиканың 1-ші заңы мына түрде жазылады:
болғандықтан, термодинамиканың 1-ші заңы мына түрде жазылады:
 (2.9.1)
(2.9.1)
2) Изобаралық процесс кезінде 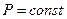 болады. Бұл процесс кезінде істелінетін жұмыс
болады. Бұл процесс кезінде істелінетін жұмыс
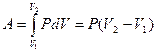 (2.9.2)
(2.9.2)
немесе келесі тұрде жазуға болады:
 (2.9..3)
(2.9..3)
Бұл процесс үшін термодинамиканың 1-ші заңы мына түрде жазылады:
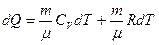 (2.9.4) мұндағы
(2.9.4) мұндағы
 (2.9.5)
(2.9.5)
3) Изотермиялық процесте 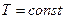 , ендеше
, ендеше
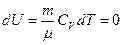
ал газдың істейтін жұмысы
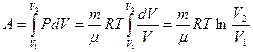 (2.9.6)
(2.9.6)
онда термодинамиканың 1-ші заңының осы процесс үшін жазылуы төмендегідей болады:
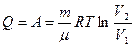
Яғни, жүйеге берілген жылу түгелімен жұмысқа жұмсалады.
2.10 Адиабаталық процесс
Жүйе сыртқы ортамен жылу алмаспай өтетін процесті адиабаталық дейді Бұл процесте 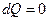 болғандықтан термодинамиканың 1-ші заңы мына түрде жазылады:
болғандықтан термодинамиканың 1-ші заңы мына түрде жазылады:
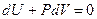
немесе
 (2.10.1)
(2.10.1)
Адиабаталық процесс кезінде жұмыс ішкі энергия есебінен істеледі. Адиабаталық ұлғаю кезінде  , онда
, онда  болады да температура төмендейді (ішкі энергиясы азаяды). Адиабаталық сығылу кезінде
болады да температура төмендейді (ішкі энергиясы азаяды). Адиабаталық сығылу кезінде  болғандықтан жүйе температурасы артады (ішкі энергиясы артады). (2.10.1) формуласын Менделеев Клапейрон теңдеуіне
болғандықтан жүйе температурасы артады (ішкі энергиясы артады). (2.10.1) формуласын Менделеев Клапейрон теңдеуіне
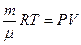 , (2.10.2)
, (2.10.2)
бөлейік.
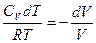 (2.10.3)
(2.10.3)
өрнекті келесі түрде жазуға болады 
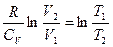 (2.10.4) (2.8.4.9) теңдеудің екі жағын Cv бөлейік. Онда
(2.10.4) (2.8.4.9) теңдеудің екі жағын Cv бөлейік. Онда
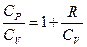 ,
,
 (2.10.5)
(2.10.5)
мұндағы 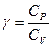 . (2.10.5) формуланы (2.10.4) –ға қойып
. (2.10.5) формуланы (2.10.4) –ға қойып
 (2.10.6)
(2.10.6)
бұл формуланы потенциялап мына түрде жазамыз:
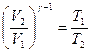 (2.10.7)
(2.10.7)
Газ күйінің теңдеуінен
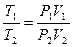 (2.10.8) қатынасын жаза аламыз.
(2.10.8) қатынасын жаза аламыз.
(2.10.7) пен (2.10.8) формулаларынан:
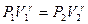 (2.10.9)
(2.10.9)
Бұл Пуассон формуласы делінеді.
Изотермиялық және адиабаталық процестердің графиктерін салыстырған жағдайда адиабата сызығының изотермаға қарағанда тіктеу болатындығы көрінеді (2.10.1-сурет).

2.10.1-сурет
Изотермиялық ұлғаюда жүйенің төмендеген ішкі энергиясын қалпына келтіріп отыру үшін, оған үздіксіз жылу беріп, ал изотермиялық сығылуда одан жылуды үздіксіз алып отыру керек. Сондықтан изотермиялық процесте қоршаған ортамен жылу алмасу жақсы болу керек.
Ал адиабаталық процесс кезінде қоршаған ортамен жылу алмасу болмау керек. Процесс адиабаталық қабықша ішінде орындалуы немесе процесс өте тез жүріп, сыртқы ортамен жылу алмасуға үлгермейтіндей болуы керек.
Адиабаталық процесс кезінде істелінетін жұмысты есептейік.
(2.10.1) формуланы мына түрде жазамыз:

немесе
 (2.10.10)
(2.10.10)
(2.10.5) формуладан
 (2.10.11)
(2.10.11)
(2.10.7) және (ІІІ.18.11) формулаларды (2.10.10) формулаға қойып:
 (2.10.12)
(2.10.12)
адиабаталық жұмысты анықтауға болады.
2.11 Дөңгелектік процесс. Жылу машиналары
Газ ұлғая отырып С1 күйден С2 күйге келсін, бұдан соң сығылу арқылы қайтадан С1 күйіне келсін. Ұлғаю С1С’C2 қисығы бойымен, ал сығылу C2C’’C1 қисығы бойымен жүрсін. С1С’C2С1 қисығы арқылы өрнектелген толық процесс дөңгелектік процесс делінеді (2.11.1- сурет).
Ұлғаю кезіндегі жұмыс C1C’C2B2B1 фигурасының ауданы арқылы анықталады, бұл жұмыс А1>0 болады.

2.11.1- сурет
Сығылу кезіндегі жұмыс C1C’’C2B2B1 фигурасының ауданы арқылы анықталады, бұл жұмыс А1<0 болады. Газдың толық жұмысы А=A1+A2 арқылы анықталады. Бұл суреттегі C1C’C2B2B1 мен C1C’’C2B2B1 фигураларының айырмасы арқылы анықталады, бұл аудан C1C’C2C’’C1 фигурасының ауданына тең болады. Бұл кезде А>0 болады.
С1 күйдегі заттың ішкі энергиясын U1, ал C2 күйдегі ішкі энергиясын U2 дейік. C1C’C2 қисығы бойынша ұлғаю кезіндегі жұмыстық дененің алған жылуын Q1, ал C2C’’C1 қисығы бойынша сығылу кезінде берген жылуын Q2 дейік. Сонда термодинамиканың 1-ші заңын мынадай болады:
 (2.11.1)
(2.11.1) 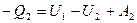 (2.11.2)
(2.11.2)
(2.11.1) және (2.11.2) формулаларды бір-біріне қосқанда
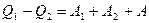 .
.
жүйе жұмысы жылулар айырмасының нәтижесінде істеледі. Сол кездегі пайдалы әсер коэффициенті (п.ә.к):
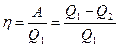 (2.11.3)
(2.11.3)
Жылу машинасының жұмыс істеу принципі 2.11.2-суретте көрсетілген. Мұндағы Q1 – жұмыстық дененің қыздырғыштан алған жылуы, Q2 – жұмыстық дененің суытқышқа берген жылуы. Жұмыстық дененің істеген жұмысы

Егер циклді кері жүргізсе суытқыш машинаның циклі шығады (2.11.3-сурет).
Ұлғаю C1C’’C2 қисығымен орындалса, істелген жұмыс A1>0, ал сығылу C2C’C1 қисығымен орындалса, істелген жұмыс A2<0.

2.14.2.1 – сурет


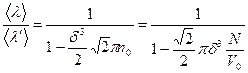
Бұл өрнектегі  деп алған алғанда
деп алған алғанда
 .
.
теңдігі шығады. Ендеше (2.14.2.1) формуланы
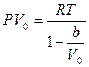
немесе

деп жазуға болады.. Бір молекуланың көлемі 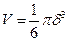 болғандықтан
болғандықтан
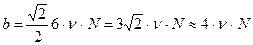
мұндағы нN – 1моль газдағы молекуланың көлемі. Сонда Ван-Дер-Ваальс түзеткіші  молекуланың алатын өз көлемінің 4 еселігіне тең болады.
молекуланың алатын өз көлемінің 4 еселігіне тең болады.
Екінші себеп әсерлесу күші дедік. Идеал газда ол ескерілмеген. Нақты газдарда тартылыс күшінің әсерінен ішкі қысым деп аталатын қосымша қысым пайда болады. Сондықтан идеал газ теңдеуіндегі Р қысымның орнына (Р+Р1) алыну керек. Молекулалардың өзара тартылыс күші ыдыс ортасындағы молекулаларға жан-жағынан әсер етеді де, олардың бір-біріне әсері компенсацияланады. Қабырға жақтағы молекулаларды газ өзіне қарата тартады. (2.14.2.2)-суреттегі  қабатындағы молекулалар саны n0 және қабырғадан тебілуші молекулалар саны n0,
қабатындағы молекулалар саны n0 және қабырғадан тебілуші молекулалар саны n0, 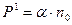 , ал
, ал 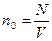 екендігін ескеріп қосымша энергия үшін мынадай теңдік жазамыз:
екендігін ескеріп қосымша энергия үшін мынадай теңдік жазамыз:
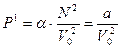
мұндағы  деп белгілеу енгіземіз.
деп белгілеу енгіземіз.

2.14.2.2-сурет
Қорыта келе
 (2.14.2.2)
(2.14.2.2)
деп жазамыз. Осы теңдікке 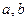 ескермеген жағдайда
ескермеген жағдайда 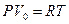 теңдеуі шығады. Бұл теңдеу тек төменгі қысымдарда ғана дұрыс болады. Ван-Дер-Ваальс теңдеуі мен Менделеев-Клапейрон теңдеулерін салыстырайық (4-кесте)
теңдеуі шығады. Бұл теңдеу тек төменгі қысымдарда ғана дұрыс болады. Ван-Дер-Ваальс теңдеуі мен Менделеев-Клапейрон теңдеулерін салыстырайық (4-кесте)
4-кесте
| Қысым (атм) | PV | (P+(a/V02))(V0-b) |
| 1,0000 | 1,000 | |
| 0,9941 | 1,000 | |
| 1,0483 | 1,009 | |
| 1,3900 | 1,014 | |
| 2,0685 | 0,893 |
Аса жоғары қысымда Ван-Дер-Ваальс теңдеуі де дәл орындалмайды екен, бірақ Менделеев-Клапейрон теңдеуіне қарағанда дұрысырақ орындалатындығы көрінеді.. Кез келген массалы газ үшін 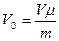 деп, оны (2.14.2.2) теңдеуге қойсақ
деп, оны (2.14.2.2) теңдеуге қойсақ
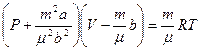
теңдігі шығады.
2.14.3 Ван-Дер-Ваальс изотермалары. Заттың кризистік күйі
Ван-Дер-Ваальс теңдеуі

үшінші дәрежелі алгебралық теңдеу. Осы теңдеу бойынша әрбір температураға сәйкес изотермалар салайық (2.14.3.1-сурет). Тек жоғары температураларда ғана Ван-Дер-Ваальс изотермалары Бойль-Мариотт изотермаларына ұқсас болады. Төменгі температураларда Ван-Дер-Ваальс изотермалары өркештер береді.

2.14.3.1-сурет
Әр қысым Р-ға бірнеше V01,V02... көлемдер сәйкес келеді. Осыны түсіну үшін эксперимент нәтижесіне тоқталайық. (2.14.3.2)-суретте эксперименттік изотермалар көрсетілген. Изотермалар жоғары температураларда идеал газ изотермаларына ұқсас. Төменгі температураларда изотерма сипаты тіпті басқаша.
Тәжірибенің қондырғысы (2.14.3.3) -суретте көрсетілген. Қалың қабырғалы цилиндр ішінде 1 моль көмірқышқыл газы бар (тәжірибе кезінде температура тұрақты болады). Суреттегі G – манометр, В-поршень.

2.14.3.2-сурет
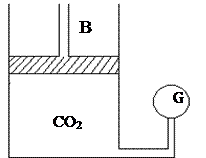
2.14.3.3-сурет
Поршеньді төмен қарай қозғай отырып қысымды арттырайық, сонда газдың көлемі кішірейеді. (2.14.3.4) -суреттегі ON қисығы. Ары қарай қысым Р0-ге жеткенде көлем кішірейгенмен қысым өзгермейді. СО2 сұйыла бастайды. Бұл уақытта көлем  -ге тең болады. Енді көлем кішірейе берген сайын газ көбірек сұйыла бастайды. M нүктесінде газ тегіс сұйыққа айналады. Бұл кезде көлем
-ге тең болады. Енді көлем кішірейе берген сайын газ көбірек сұйыла бастайды. M нүктесінде газ тегіс сұйыққа айналады. Бұл кезде көлем 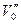 болады. Әрі қарай сығылу қиындала бастайды.
болады. Әрі қарай сығылу қиындала бастайды.

2.14.3.4-сурет
Р0 қысым Т температурадағы қаныққан бу серпімділігі делінеді. Осы қысымда берілген зат 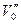 пен
пен  арасындағы көлемдерді ала алады. Бұл аймақта газ екі агрегаттық күйде бола алады. Теориялық изотермадағы өркештер заттардың газ күйінен сұйық күйіне ауысып отыратындығын көрсетеді. Графикте пунктермен бөлінген бөлік сұйық газ, штрихтар сұйықты көрсетеді (2.14.3.2-сурет). Ван-Дер-Ваальс изотермалары ішінде өркештелген изотерма мен өркештелмеген изотермаларды бөліп тұрған изотерма бар. Мұны кризистік изотерма деп атайды да оған сәйкес температураны кризистік Тk дейді. Бұл К нүктесінде өркештер орнына майысу ғана болады. К – кризистік нүкте, Vок - кризистік көлем. Рk – кризистік қысым делінеді. Сонымен:
арасындағы көлемдерді ала алады. Бұл аймақта газ екі агрегаттық күйде бола алады. Теориялық изотермадағы өркештер заттардың газ күйінен сұйық күйіне ауысып отыратындығын көрсетеді. Графикте пунктермен бөлінген бөлік сұйық газ, штрихтар сұйықты көрсетеді (2.14.3.2-сурет). Ван-Дер-Ваальс изотермалары ішінде өркештелген изотерма мен өркештелмеген изотермаларды бөліп тұрған изотерма бар. Мұны кризистік изотерма деп атайды да оған сәйкес температураны кризистік Тk дейді. Бұл К нүктесінде өркештер орнына майысу ғана болады. К – кризистік нүкте, Vок - кризистік көлем. Рk – кризистік қысым делінеді. Сонымен:
1) Тk - кризистік температурадан жоғарғы температурада зат тек газ күйінде болады. Кризистік температурадан жоғарғы температура газды ешқандай қысыммен сұйылтуға болмайды. Тk – ден төменгі температурада газ сұйық күйінде де, газ күйінде де болуы мүмкін.
2) Р0 қаныққан бу серпімділігі Рk кризистік қысымнан артық бола алмайды.
3) Заттың сұйық күйіндегі көлемі осы заттың сондай мөлшердегі кризистік көлемінен үлкен бола алмайды. Кризистік нүктеде сұйық және бу арасында айырма болмайды.
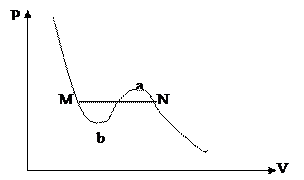
2.14.3.5-сурет
Экспериментальды изотермада өркештер аймағы MN түзуі арқылы көрсетілген (2.14.3.5-сурет).
Тозаңсыз және электр зарядтары жоқ жерде будың қысымы Р қаныққан бу серпімділігінен жоғары болуы мүмкін. Мұны аса (Na) қаныққан бу деп атайды.
Заттың сұйық күйіндегі қысымы қаныққан бу серпімділігінен төменгі қысымда бола алады. Ол чертежде вМ сызығымен көрсетілген. ав – бөлігі тұрақсыз күй болып табылады. Өйткені, көлемнің үлкеюімен қатар қысымның да артып отыруы мүмкін емес.
2.14.4 Нақты газдардың ішкі энергиясы
Идеал газдардың ішкі энергиясы молекулалардың ілгерілемелі және айналмалы қозғалысының кинетикалық энергияларынан тұрады. Ал нақты газдарда молекулардың өзара әсерін ескеру қажет. Ендеше қосымша энергия:
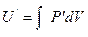 (2.14.4.1)
(2.14.4.1)
Қосымша қысым 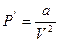 болғандықтан
болғандықтан
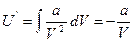
Сонда нақты газдың толық энергиясы
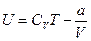 (2.14.4.3) болады
(2.14.4.3) болады
Нақты газдың ауасыз кеңістікке қарай ұлғаюын қарастырайық. Нақты газдарда идеал газдардағы сияқты газ ұлғайғанда істелетін жұмыс газға жылу берудің немесе ішкі энергия есебінен істеледі. Нақты газ ауасыз кеңістікке ұлғайсын, бұл уақытта сыртқы қысым жоқ деп есептеуге болады. Сондықтан газ сыртқы күштерді жеңуге жұмыс жасамайды, бірақ молекулалардың арасында ілінісу бар. Газ ұлғайғанда осы ілінісу күштерін жеңуге жұмыс жасайды. Бұған ішкі энергияны бірден жұмсауға тура келетіндіктен газдың температурасы кемитін болады..
Мынадай тәжірибе қарастырайық:
Ыдыс қалқанмен бөлінген болсын. Қалқанның бір жағы газ, екінші жағы бостық (вакуум) болсын. Қалқанды алып тастағанда газ бостыққа ұмтылады. Молекулалардың арасы қашықтап, ілінісу күштерін жеңеді. Энергияның сақталу заңы бойынша газдың толық ішкі энергиясы ұлғайғанға дейін де және ұлғайғаннан кейіннен де өзгермейді.


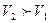 болғандықтан газ бостыққа ұлғайғанда температура азаяды.
болғандықтан газ бостыққа ұлғайғанда температура азаяды.
2.14.5 Фазалық түрлену. Булану және қайнау
Фаза деп заттың басқа тепе-тең күйлерінен физикалық қасиеттері жағынан ерекшеленетін термодинамикалық тепе-теңдік күйін айтады. Фаза ұғымын көбінесе заттың агрегат күйі ұғымы ретінде қолданылады. Бірақ оның мағынасы кеңірек. Бір агрегат күй аралығында зат бірнеше фазада бола алады. Заттың фазалық ауысуы- бір фазадан келесі фазаға- заттың қасиетінің сапалық өзгеруімен байланысты болады. Фапзалық ауысудың екі тегі болады. Бірінші реттік фазалық ауысуға мынадай процесстер жатады: балқу, кристалдану, булану, конденсациялану …), ол жылудың бөлінуі не жұтылуы арқылы сипатталады. Мысалы, 1г мұзды суға айналдыру үшін қалыпты атмосфералық қысымда Q=80 кал. жылу беру керек, ал 1г суды 1 атм. қысымда 1000 С температурада буға айналдыру үшін Q=540 кал. жылу беру керек. Кері процестерде будың суға айналуы үшін, судың мұзға айналуы үшін осы алған жылулар бөліну керек.
Сұйықтан буға айналу процесін қарастырайық. Қайнау процесінде үлкен кинетикалық энергиясы бар сұйық молекулалары сұйықтың бетіне шығып, молекулааралық тартылысты жеңіп, сұйық бетінен шығып кетуі керек. Яғни
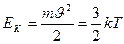
энергиясы молекулалардың тартылыс күшіне қарсы істелетін жұмыстан көп болуы керек (Ek>A.). Бұл жұмыс A=2r.F теңдігі арқылы анықталады. Мұндағы r – молекулалардың әсерлесу сферасының радиусы, Ғ - әсерлесу күші.
Молекулалардың тартылыс күші өте үлкен шама. Судың молекулалық ішкі қысымы 11 мың атм. Ендеше молекуланың сұйық бетіне шығуы үшін өте үлкен энергия керек. Энергиясы көбірек молекулалар ғана, яғни «ыстық» молекулалар ғана сұйық бетіне шыға алады. Осының нәтижесінде қалған молекулалардың энергиясы азаяды. Кебу кезінде дене суыйды. Булануға кері процесс қоса жүреді. Яғни ауадағы су буы қайтадан сұйыққа айналады. Екі процесс үздіксіз жүреді. Егер булану конденсацияға қарағанда интенсивті болатын болса, сұйық буланады, ал керісінше конденсациялану булануға қарағанда интенсивті жүрсе онда сұйық көбейеді.
Екі процесс тең болса тепе-теңдік процесс делінеді, яғни қанша молекула буланса, сонша молекула конденсацияланады. Бұл уақыттығы буды қаныққан бу дейді.
Егер адиабаталық кебу болса, температура төмендейді. Изотермалық кебуде (тұрақты температурада) берілген жылу тұрақты болады. Сұйықты қайнауға дейін қыздырғанда жылудың біразы ғана булануға жұмсалады, ал көп бөлігі тек қыздыруға кетеді. Қайнау басталу үшін сұйықтың ішінде ауа көпіршіктері болуы керек, яғни қос фазалы болу керек.
Ауа көпіршіктері сұйықтың ішінде ыдыс қабырғасындағы не түбіндегі денелерге жабысып тұрады. Осы көпіршіктер булану орталығы болып табылады. Сұйық осы көпіршіктің ішінде буланады, көпіршік үлкейіп өз орнына кішкене көпіршік қалдырады да сұйық бетіне көтеріліп жарылады. Кішкене көпіршік тағы ұлғайып, тағы көтеріледі. Осылай қайталану болады. Көпіршіктер тізбек жасап көтеріліп отырады.
Қайнау кезінде сұйыққа берілген жылу түгелдей булануға жұмсалады, ендеше температура тұрақты болады. Мұның себебі - температураның көтерілуі мұң екен, сол сәтте-ақ қайнау тездей бастайды. Яғни келген жылу кебуге кеткен жылумен тең болады. Көпіршік ауадан тұруы керек, ал көпіршік тек сұйық буынан тұрса қысым көбейгенде (тепе-теңдік қалыптан жоғары болғанда) бу суға айналып көпіршік көлемі кішіриеді. Көпіршік үшін тепе-теңдік қалып мынадай
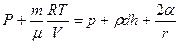
Мұнда Р – көпіршік ішіндегі қаныққан бу қысымы, 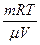 – көпіршік ішіндегі ауа қысымы, р – атмосфералық қысым,
– көпіршік ішіндегі ауа қысымы, р – атмосфералық қысым, 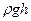 – гидростатикалық қысым,
– гидростатикалық қысым, 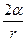 – қисық беттегі Лаплас қысымы.
– қисық беттегі Лаплас қысымы.
Ұзақ қайнаудан кейін аса қызған сұйық алуға болады. Бұл жағдай сұйықтың ішіндегі еріген ауа түгелдей буланып болған соң бу тек сұйықтың өз буы болған кезде ғана орындалады. Қайнау температурасы жоғарылайды.
Булану жылуы екі бөліктен тұрады. Біріншісі молекуланың беттік қабаттан бөлінуі үшін қажет, ал екінші бөлігі ұлғаю кезіндегі жұмысқа тең. Кебу кезінде будың көлемі алғашқы сұйық күйінен үлкен болады. (Су үшін 1650 есе).
Кебу жылуы л беттік қабаттың тартуын жеңу үшін жұмсалатын лі және ұлғаю үшін кететін ле жылулардың қосындысына тең болады.
л=лi+лe
Ұлғаю үшін қажетті жылу  . Беттің тартылысын жеңу үшін жұмсалатын жылу:
. Беттің тартылысын жеңу үшін жұмсалатын жылу: 
Будың конденсациялану процесін қарастырайық. Бұл процесс тек қос фаза болғанда орындалады. Конденсация болу үшін конденсация орталығы болу керек. Будың молекулалары осындай орталыққа жанасып, үлкен тамшы құрайды да сұйық бетіне түседі. Ауаны ерекше тазартып аса қаныққан бу алуға болады. Бұл уақытта қысым тепе-теңдік қысымнан жоғары болады. Аса қаныққан буды адиабаттық ұлғайтса температура төмендейді де конденсация болады. Конденсация кезінде булану жылуы қайта бөлінеді.
2.14.6 Екінші реттік фазалық түрлену туралы түсінік
Бірінші реттік фазалық ауысу жылуды жұту не бөлу арқылы орындалады. Екінші реттік фазалық ауысуда жылу шығару не жұту болмайды, тек жылу сыйымдылық не басқа физикалық қасиеттері өзгереді. Мысалы, Т=и болғанда ферромагнетиктер парамагнетикке айналады және жылу сыйымдылығы өзгереді.
Төменгі температурада T=2,9K болғанда сұйық гелий ерекше фазалық күйге – гелий-II-ге айналады. Бұл уақытта үйкеліс көэффициенті өте аз болады да, «төтенше аққыштық» қасиетке ие болады. Ол d=0,5.10-3мм саңылаудан аға береді. Кәдімгі сұйық мұндай саңылаудан өтпейді. Төтенше өткізгіштік күйлерде кедергі болмайды.
2.14.7 Күй диаграммасы. Фазалардың тепе-теңдігі
Кейбір кристалды заттар атмосферада қатты күйде де тез буланады. Мысалы, нафталин, мұз (қысты күні далаға жайылған кірдің кебуі). Мұндай денелер үстіндегі бу қысымын өлшеуге болады. Ал көптеген заттар үшін өлшеуге мұмкін болмайды. Бірақ кез келген қатты дененің молекулалары ретсіз қозғалыста болады да денеден атмосфераға ұшып кетеді және керісінше процесс өтеді.
Қатты дененің булануын сублимация деп атайды (жоғары көтерілген деген сөз). Сублимация жылуы балқу жылуы мен булану жылуының қосындысына тең болады. Сублимация процесіне кері процесс будың қатты күйге айналу процесі болады. Сұйық және оның буының динамикалық тепе-теңдігі кез келген температурада болады. Осының тепе-теңдік нүктелердің геометриялық орны булану қисығын береді: РК – булану қисығы, К – кризистік нүкте (2.14.15-сурет).
Сол заттың қатты және сұйық фазасының динамикалық теңдігінің геометриялық нүктелер орны балқу қисығы делінеді (ВР).
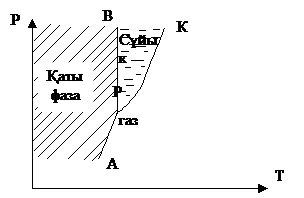
2.14.15.1-сурет
Бір өлшем уақыт ішіндегі сұйықтан қатты фазаға келетін молекулалар саны, қатты күйден сұйық фазаға баратын молекулалар санына тең болады. Булану қисығы және балқу қисығы бір нүктеде - Р нүктесінде түйіседі. АР – қисығы сублимация қисығы делінеді (қатты газ күйі динамикалық тепе –теңдікте болу қисығы). Р нүктесі үш қисықтың түйісу нүктесі. Оны үштік нүкте деп атайды.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 4138; Нарушение авторских прав?; Мы поможем в написании вашей работы!