
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эксцизионная репарация нуклеотидов у эукариот
|
|
|
|
Эукариоты, включая дрожжи и человека, не имеют прямых гомологов системы UvrABC, но сам механизм NER у них чрезвычайно сходен с таковым у прокариот.
Системой NER у эукариот удаляются крупные ДНК-аддукты, такие как 4-6-фотопродукты, пиримидиновые димеры, индуцированные УФ-светом и другие повреждения, возникающие под действием различных генотоксических агентов, например, бензопирена или афлатоксина. В нее вовлечено не менее 30 белков. Белки, участвующие в этом процессе были изолированы из почкующихся дрожжей Saccaromyces cerevisiae, из делящихся дрожжей Shiyzosaccaramyces pombe и из клеток млекопитающих (преимущественно грызунов и человека). Главное открытие, связанное с этим – высокое структурное и функциональное постоянство этих генов у столь разных организмов, которое можно распространить на всех эукариот. Вывод о том, что механизм NER сходен, если не идентичен у всех видов эукариот, означает, что данные полученные на одних организмах, можно смело приложить к другим. Дефекты NER у человека приводят к появлению различных наследственных синдромов (XP, CS, TTD, UVSS), о которых мы поговорим ниже.
Прежде чем углубляться в подробности, неизбежно придется остановиться на вопросах номенклатуры. Хорошо известен тот печальный и неизбежный опыт, что мутанты и соответствующие им гены приходится обозначать до того, как становятся понятны их структура и функции, к тому же в разных областях при использовании различных экспериментальных моделей складываются свои системы номенклатуры. Это часто приводит к путанице, и гены репарации ДНК не являются в этом смысле исключением. У дрожжей соответствующие гены обозначаются и у S.serevisise и у S.pombe как Rad и rad (от radiation), но их порядковые номера не совпадают. (Например, ген Rad3 S.sereviseae и ген rad3 S.pombe – совершенно разные, а гомологом гена Rad3 является ген rad15). У млекопитающих обозначение репарационных мутантов и генов имеют разное происхождение. В экспериментах на клетках грызунов были выделены мутанты, относящиеся к 11 группам комплементации и имеющие различные дефекты ЭР, а человеческие гены, комплементирующие эти мутанты обозначили ERCC (Exision Repair Cross Complementing) 1-11. У человека же соответствующие мутанты были получены от больных с различными наследственными нарушениями репарации – пигментной ксеродермой (XP), синдромом Коккейна (CS) и трихотиодистрофиeй (TTD). Различные группы комплементацтии этих штаммов были обозначены в соответствии с источником их получения: XP-A (B,C,D,E,F,G), CS-A, CS-B, TTD-A, а их гены – XPA, XPB и т. д. Когда все эти гены были клонированы и анализированы, стало очевидно, что некоторые ERCC, XP, CS и TTD гены идентичны. Например, ERCC2 и XPD. В таких случаях было принято, что обозначение ERCC следует, когда это возможно, заменять на обозначение гена болезни. К тому же другими способами были изолированы еще некоторые гены, вовлеченные в процесс NER, соответственно с независимыми названиями. Для того, чтобы мы могли легко ориентироваться в этом многообразии, приведем табл. 4 со всеми сводными данными по названиям генов, вовлеченных в NER
Эта таблица облегчит нам дальнейшее изложение материала. Почти во всех случаях гены обоих видов дрожжей были клонированы по их способности комплементировать УФ-чувствительность соответствующих мутантов.
Гены ЕRCC были клонированы подобным же образом при использовании геномной ДНК человека для обработки мутантных клеточных линий грызунов с последующим восстановлением нормальной УФ-чувствительности и клонированием корректирующей ДНК. Клонированные ERCC гены были затем введены путем трансфекции или микроинъекций в клетки, принадлежащие больным с различными синдромами. Так было установлено соответствие между генами ERCC и генами, отвечающими за некоторые человеческие болезни. Общая схема этого процесса у эукариот представлена на рис. 12.
В действительности эта схема несколько упрощена, так как NER может осуществляться двумя путями – общей репараций генома (global genomic repair, GGR) и репарацией, спаренной с транскрипцией (transcription-coupled repair, TCR), а данная схема описывает собственно только процесс GGR, который очень хорошо изучен. Разберем этот процесс подробнее.
1(а). Распознавание повреждения. Комплексы XPC-HR23A и RPA-XPA (именно эти белки изображены на схеме) находят повреждения ДНК. XPC-HR23A высокоспецифично распознает 6-4-фотопродукты, но не пиримидиновые димеры, 8-оксигуанин или О6-метилгуанин. RPA-XPA напротив, узнают и 6-4PP и ДНК-сшивки. Неясно, какой из комплексов начинает процесс, мнения ученых противоречивы.
Вероятнее, что это RPA-XPA, так как ХРА может двигаться по ДНК, как бы отыскивая повреждение, пока на него не наткнется. Оба эти комплекса могут быть задействованы и в GGR, и в TCR
Другой белковый комплекс, распознающий пиримидиновые димеры, состоит из двух «белков, связывающихся с поврежденной ДНК» (damaged DNA binding protein, DDB1 (h127) и DDB2 (p48), он же XPE). Этот комплекс участвует только в GGR, но не в TCR. При этом его сродство к поврежденной ДНК крайне высоко – в 500 000 раз выше, чем к интактной, вероятно, поэтому он может первым связаться с повреждением, обнаруженным комплексом XPC-HR23A на нетранскрибируемой нити, а также привлечь к месту повреждения комплекс RPA-XPA. Очень важным наблюдением является то, что дефектные по Р53 клетки человека имеют сниженную активность GGR и нарушение репарации пиримидиновых димеров.
Это связано с тем, что транскрипция генов XPC и DDB2 (XPE) зависит от Р53 и индуцируется УФ-облучением. Клетки больных синдромом Ли-Фромени (мутантные по гену р53) таким образом являются дефектными по репарации пиримидиновых димеров, так как в них отсутствует Р53-зависимая индукция DDB2. У человека ХРС индуцируется не только УФ-светом, но и алкилирующими агентами и бензопиреном. При этом у мышей нет индукции DDB2 под действием УФ-облучения. Недавно получены крайне интересные данные о том, что при дефекте Р53 ХРС и ХРЕ могут быть индуцированы оверэкспрессией BRCA1 (белок, связанный с развитием семейных форм рака молочной железы и яичников, breast cancer 1).
2 (б). Раскручивание ДНК. После распознавания повреждения к нему подходит фактор транскрипции РНК-полимеразыII – TFIIH, состоящий из 7 субъединиц (XPB, XPD, GTF2H1, GTF2H2, GTF2H3, GTF2H4, CDK7, CCNH, MNAT1). В большинстве случаев это привлечение осуществляется комплексом XPC-HR23A. TFIIH обладает геликазной активностью благодаря геликазам ХРВ и ХРD, раскручивающим ДНК около повреждения в разные стороны.
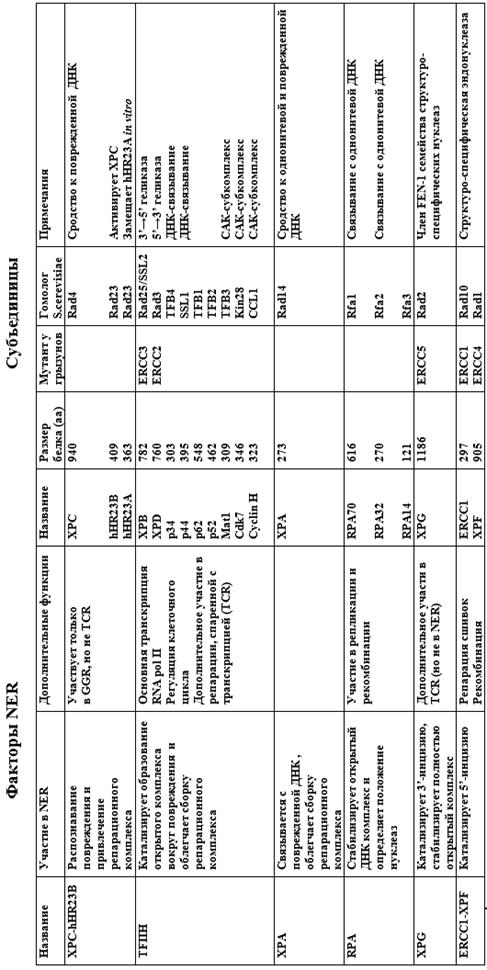 Таблица 4
Таблица 4
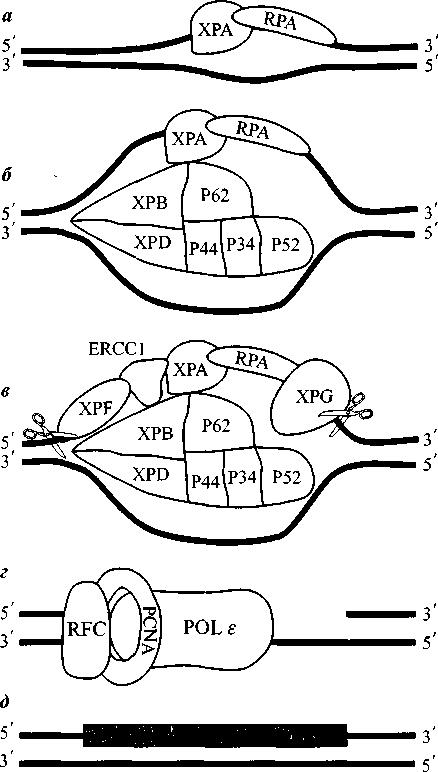
Рисунок 12. Схема процесса NER у эукариот.
3 (в). Эксцизия повреждения ДНК. После распознавания ДНК и образования открытого комплекса, ДНК надрезается с двух сторон от повреждения. 3’-инцизия осуществляется эндонуклеазой XPG, а 5’-эндонуклеазным комплексом XPF-ERCC1.
4 (г-д). Репаративный синтез и лигирование. Образовавшаяся брешь заполняется ДНК-полимеразами δ и ε и сшивается ДНК-лигазой I при участии сопутствующих факторов.
5.3.2.NER, спаренная с транскрипцией: TCR (transcription coupled repair)
В начале 80-х годов Филипп Ханавалт сформулировал представление о преимущественой репарации ДНК. Это явление заключается в более быстром удалении цикдобутановых пиримидиновых димеров и некоторых других типов повреждений оснований из транскрипционно активных генов по сравнению с транскрипционно молчащими участками генома. Окончательное понятие (на сегодняшний день) преимущественной репарации таково: во многих, но не во всех, транскрипционно активных генах транскрибируемая (матричная) нить репарируется быстрее, чем нетранскрибируемая (кодирующая) нить (нить-специфическая репарация); и транскрибируемая часть генома репарируется быстрее, чем молчащая. Существование эксцзионной репарации нуклеотидов, спаренной с транскрипцией, как раз и является доказательством этой гипотезы.
У E.coli обнаружен мутант mdf (mutation frequency decline) с нарушением NER. Оказалось, что этот ген кодирует белок, названный TRCF (transcription repair cupling factor), который «убирает» комплекс РНК-полимеразы вместе с транскриптом с ДНК, если тот остановиться перед повреждением, способствуя таким образом репарации данного повреждения. То есть вся система репарации, спаренной с транскрипцией, отличается от описанного нами ранее процесса NER только одним этим фактором.
Такие белки, как фактор связывания транскрипции и репарации (transcription Repair Cupling Factor, TRCF), явно вовлеченные в объединение транскрипции и эксцизионной репарации в то же время не являются белками, абсолютно необходимыми для транскрипции самой по себе.
TCR убирает различные повреждения, останавливающие продвижение РНК-полимеразы на транскрибируемой нити транскрибируемого гена. Дефект этого пути репарации приводит к Синдрому Коккейна (СS), при этом при данном заболевании вообще резко снижен уровень транскрипции и его относят к так называемым «транскрипционным синдромам», а не только к «репарационным синдромам». Именно с этим связано то, что уровень опухолеобразования у больных синдромом Коккейна не повышен, по сравнению с контролем – клеткам просто не хватает транскрипционной активности для поддержания опухолевых, активно пролиферирующих клеток. Хотя есть предположение, связывающее это явление с повышенным уровнем апоптоза. Для TCR основными необходимыми белками являются CSА, CSB, XPB, XPD (члены TFIIH) и XPG. CSB, но не CSA непосредственно связывается с РНК-полимеразой II (хотя не совсем понятно, как именно) и таким образом активирует соответствующую ветвь NER, что приводит к отсоединению остановившегося комплекса RNApolII от поврежденной ДНК. TCR и GGR могут быть объединены белком CSB, вероятно, он работает как «фактор, разделяющий транскрипцию и репарацию». CSB использует свою способность к транслокации ДНК для того, чтобы отделить комплекс RNApolII от остановленной вилки транскрипции. После обработки клеток таким агентом, как цисплатин или после УФ-облучениия наблюдается CSA и CSB-зависимая убиквитинирование RNApolII комплекса, облегчающая его перемещение и последующий протеолиз.
У дрожжей описаны дополнительный фактор Def1, взаимодействующий с Rad26 (гомолог CSB), ответственный за убиквитинирование и протеолиз RNApolII в тех случаях, когда повреждение не может быть отрепарировано. Есть ли гомолог этого фактора у человека – неясно. Для восстановления транскрипции RNApolII должна снова оказаться в гипофосфорелированной форме (только так она связывается с ДНК), количество которой резко падает после УФ-облучения. Может быть, при участии комплекса TFIIS, RNApolII комплекс не отходит от ДНК, а лишь перемещается назад на 20–35 нуклеотидов от повреждения, что позволяет ему вернуться к прерванной работе после завершения процесса репарации. Вероятно, в TCR принимают участие еще два фактора – человеческий гомолог фактора 2 (HuF2, TTF2) и АТФ-зависимфй фактор терминации RNAPII, которые также помогают убирать остановившиеся перед повреждениями РНК-полимеразы I и II. Возможно, в этот процесс вовлечен и один из белков MMR – MSH2.
Современные представления о различных системах эксцизионной репарации и их взаимосвязи могут быть хорошо отражены на рис. 13, где представлена схема, предложенная Г.Спивак, которая даже выделяет TCR в отдельный тип эксцизионной репарации нуклеотидов, а GGR считает синонимом NER.
На схеме показано, что при NER (GGR) повреждения распознаются комплексом XPC-HHR23 и, в некоторых случаях ДНК-связывающей активностью, контролируемой белком ХРЕ. Субъединицы комплекса TFIIH XPB/XPD геликазы вместе с белком ХРА и PCNA открывают ДНК вокруг повреждения. Инцизия эндонуклеазами XPG и XPF-ERCCI предшествует эксцизии олигонуклеотида, содержащего повреждение. Брешь заполняется ДНК полимеразами δ или ε, причем реакция требует присутствия RFC, PCNA и RPA. ДНК лигазаI завершает реакцию восстановления непрерывности ДНК. При BER гликозилаза, которая может быть стимулирована XPG, распознает повреждение и удаляет основание. Получившийся АР-сайт распознается АР-эндонуклеазой (АРЕ) или АР-лиазой (в некоторых случаях АРЕ и АР-лиазная активности совмещены в одном и том же белке.) Продукт действия АРЕ или АР-лиазы содержит 5’ или 3’ терминальный остаток, к которому и прилагается ДНК-полимеразная активность полимеразы β или, соответственно, еще одна АРЕ-активность.
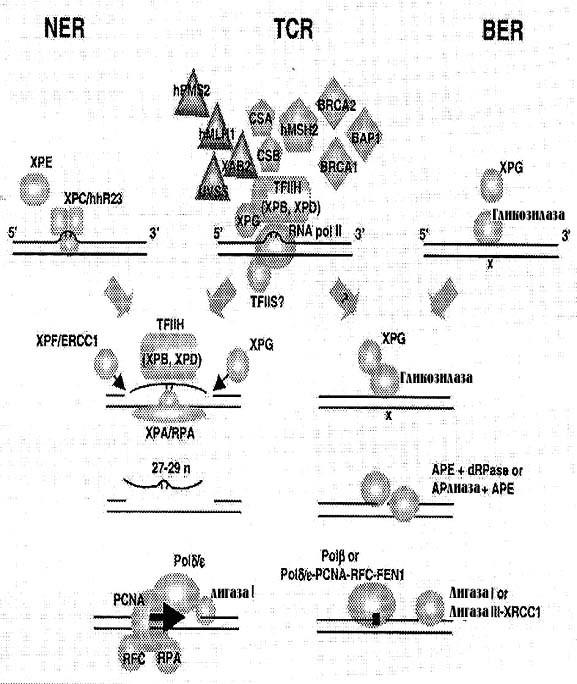
Рисунок 13. Схематическая модель путей эксцизионной репарации ДНК у эукариот. Объяснение в тексте.
Однонуклеотидная брешь заполняется ДНК-полимеразой β, а синтез длинного участка (6-14 нуклеотидов) обычно проводят полимеразы ε/δ, PCNA, RFC и FENI. Лигаза I или комплекс лигазаIII/XRCCI завершают репарационную реакцию.
Распознавание повреждения при TCR является очень сложным, оно инициируется в момент остановки РНК-полимеразы II перед повреждением, затем TFIIH и XPG призываются в тоже место, возможно, в зависимости от природы препятствия. Дополнительные факторы, необходимые для всех типов повреждений, обозначены пятиугольниками, для массивных аддуктов – треугольниками, для поврежденных оснований – ромбами. В случае, если транскрипционный комплекс убирается или переносится, репарация протекает по пути NER, BER или другому специальному пути. Обратите внимание, что в распознавании повреждений при TCR принимают участие белки системы MMR – hMSH2, hPMS2, hMLH1.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1733; Нарушение авторских прав?; Мы поможем в написании вашей работы!