
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов
|
|
|
|
КОРРОЗИЯ -процесс самопроизвольного разрушения металлов и сплавов под действием окружающей среды; данный процесс является окислительно-восстановительным и протекает на границе раздела фаз.
По механизму протекания коррозионного процесса, который зависит от характера внешней среды, различают химическую и электрохимическую коррозию.
Химическая коррозия – самопроизвольное разрушение металла или сплава в окислительных средах, которые не проводят электрический ток.
К ней относятся:
а) высокотемпературная коррозия в атмосфере сухих газов, т.е. при отсутствии конденсации влаги на поверхности металла или сплава (сухой воздух, хлор, сероводород и т.д.);
б) коррозия в жидких неэлектропроводных средах. К ним относятся жидкости органического происхождения (бензин, керосин, сернистая нефть и т.д.), а также ряд жидкостей неорганического происхождения (расплавленная сера, жидкий бром и др.).
Сущность химической коррозии сводится к окислительно-восстановительной реакции, которая протекает между металлом или сплавом и окислителем.
Например, хМе + у/2 О2 = МехОу
ПРИМЕР 1: Рассмотрите процесс коррозии цинковой пластины в атмосфере сухого сероводорода при температуре 400К.
ОТВЕТ: В атмосфере любого сухого газа при высоких температурах протекает химическая коррозия, сущность которой, в данном случае, сводится к окислительно-восстановительной реакции между металлом (Zn) и окислителем (H2S):
Zn + H2S = ZnS + H2
Zn – 2e = Zn2+ | 1
2H+ + 2e = H2 |1
Продуктом коррозии является сульфид цинка.
ПРИМЕР 2: Опишите процесс коррозии железного гвоздя, помещенного в бензин, который насыщен кислородом.
ОТВЕТ: В чистом виде органические растворители не реагируют с металлами, но в присутствии примесей химическое взаимодействие протекает интенсивно. В данном случае будет протекать химическое взаимодействие между железом и кислородом:
4Fe + 3O2 = 2Fe2O3
Fe – 3e = Fe3+ | 4
O2 + 4e = 2O2- | 3
Электрохимическая коррозия – самопроизвольное разрушение металла или сплава в среде электролита:
- в растворах электролитов (растворы щелочей, кислот и солей; морская вода);
- в атмосфере любого влажного газа;
- в почве
При электрохимической коррозии протекают раздельно два процесса: окисление на анодных участках и восстановление на катодных участках, при этом образуется коррозионный элемент:
nē

Ме1 / Д / Ме2
nē
где Д – деполяризатор.
Схематично процесс электрохимической коррозии можно описать следующими электродными процессами:
Анодные участки: Ме – nе = Меn+
Катодные участки: Д + nе = Дn-
Катодный процесс зависит от кислотности среды (рН):
а) если рН< 7 (в растворах кислот и солей, гидролизующихся по катиону), то деполяризатором являются ионы водорода Н+, и на катодных участках осуществляется водородная деполяризация, протекающая по схеме:
2Н+ + 2е = Н2.
б) если рН ≥ 7 (в нейтральных и щелочных средах), то деполяризатором являются молекулы кислорода, растворенные в электролите, и на катодных участках осуществляется кислородная деполяризация, протекающая по схеме:
О2 + 2Н2О + 4е = 4ОН-.
ПРИМЕР 3: Рассмотрите химические процессы, протекающие при контакте цинковой и свинцовой пластин, погруженных в раствор хлорида аммония.
ОТВЕТ: В данном случае мы имеем дело с контактной электрохимической коррозией. Е0(Zn/Zn2+) = -0,76B, a E0(Pb/Pb2+) = -0,13 B. Следовательно, цинк, характеризующийся более низким значением электродного потенциала, будет проявлять свойства анода, а свинец с большим значением электродного потенциала – свойства катода.
В водном растворе хлорид аммония подвергается процессу гидролиза по катиону слабого основания:
NH4Cl = NH4+ + Cl-
NH4Cl + H2O ↔ NH4OH + HCl
NH4+ + HOH ↔ NH4OH + H+
В результате гидролиза среда раствора становится кислой, т.к. накапливаются ионы водорода Н+ (pH < 7), следовательно, деполяризатором являются ионы водорода Н+, а на катодных участках осуществляется водородная деполяризация
Строение и работа коррозионного элемента описывается следующей схемой:
2ē

(-) Zn / NH4Cl + H2O + O2 / Pb (+)


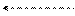 NH4ОН + HCl
NH4ОН + HCl
2ē
Анодные участки: Zn – 2e = Zn2+
Катодные участки: 2H+ + 2e = H2 (pH< 7)
Суммарное уравнение коррозии: Zn + 2H+ = Zn2+ + H2
Продуктом коррозии является хлорид цинка.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
141. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев,, и схему коррозионного элемента для случая электрохимической коррозии.
а) Шероховатая железная пластинка в среде газообразного хлора при Т>573 К;
б) Какой из двух металлов (Fe/Ti), контактирующих в конструкции, будет подвергаться разрушению? Металлическое изделие находится в растворе CuCl2;
142. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев,, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в сухом хлороводороде при Т>300 К;
б/ Каким - анодным или катодным – покрытием будет цинк, если изделие изготовлено из железа? Напишите схему коррозионного процесса, протекающего при нарушении целостности покрытия в растворе (NH4)2SO4.
143. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная алюминиевая пластина в сухом воздухе при Т>400К;
б/ В качестве протектора для защиты от коррозии стальных изделий используют алюминий. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе Mn(NO3)2.
144. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая железная пластинка в сухом воздухе при Т>373К;
б/ Какой из двух металлов (Cu/Ti), контактирующих в конструкции, будет подвергаться разрушению. Металлическое изделие находится в растворе К2S;
145. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая цинковая пластинка в сухом сероводороде при Т>300К;
б/ Каким - анодным или катодным – покрытием будет хром, если изделие изготовлено из железа? Напишите схему коррозионного процесса, протекающего при нарушении целостности покрытия в растворе Cu(NO3)2
146. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Изогнутая пластина из углеродистой стали в сухом хлороводороде при Т>300К;
б/ В качестве протектора для защиты от коррозии стальных изделий используют марганец. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе NaНCO3.
147. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая алюминиевая пластина в водяном паре при Т>423К;
б/ К какому типу покрытия относится олово на меди? Напишите схему коррозионного процесса, протекающего при нарушении целостности покрытия в растворе сульфида калия?
148. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная цинковая пластина в сухом сероводороде при Т>360К;
б/ Магниево-алюминивый сплав эксплуатируется во влажной атмосфере воздуха.
149. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Изогнутая пластина из углеродистой стали в насыщенном кислородом бензине при Т=298К;
б/ Алюминиевое изделие с медными заклепками находится в растворе Na2SO3 при Т=298 К.
150. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная алюминиевая пластина в сухом воздухе при Т>398К;
б/ Каким - анодным или катодным – покрытием будет хромолово, если изделие изготовлено из железа? Напишите схему коррозионного процесса, протекающего при нарушении целостности покрытия в растворе карбоната натрия.
151. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в сухом хлороводороде при Т>350К;
б/ В качестве протектора для защиты от коррозии стальных изделий используют цинк. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в морской воде.
152. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая железная пластинка в насыщенном кислородом керосине при Т>298К;
б/ Пластина из латуни (сплав цинка с медью) эксплуатируется в растворе серной кислоты.
153. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в насыщенном хлором керосине при Т=298К;
б/ Медное изделия, паянное серебром эксплуатируется в растворе КОН.
154. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная цинковая пластина во влажном воздухе при Т>300К;
б/ Какой из двух металлов (Cr/Sn), контактирующих в конструкции, будет подвергаться разрушению? Металлическое изделие находится в растворе CuCl2;
155. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная железная пластина в водяном паре при Т>473К;
б/ Биметаллическая композиция Cu/Ag в растворе KCl при Т=298 К.
156. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/Шероховатая алюминиевая пластинка в сухом хлороводороде при Т>380К;
б/ Какой из двух металлов (Cu/Fe), контактирующих в конструкции, будет подвергаться разрушению? Металлическое изделие находится в растворе Na2SO3;
157. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Шероховатая медная пластинка в сухом сероводороде при Т>330К;
б/ В качестве протектора для защиты от коррозии стальных изделий используют цинк. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе сульфата алюминия.
158. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в газообразном хлоре при Т>398К;
б/ Гальванопара Al/Hg находится в нейтральной водной среде.
159. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная пластина из углеродистой стали в сухих парах брома при Т>320К;
б/ Какой из двух металлов (Pb/Cu), контактирующих в конструкции, будет подвергаться разрушению? Металлическое изделие находится в растворе FeCl2;
160. Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии.
а/ Полированная алюминиевая пластина в насыщенном кислородом керосине при Т=298К;
б/ Стальное изделие, паянное оловом эксплуатируется в среде соляной кислоты.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 5091; Нарушение авторских прав?; Мы поможем в написании вашей работы!