
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая природа простых белков
|
|
|
|
БЕЛКИ
Белки – высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных пептидными связями, и имеющие сложную структурную организацию.
Белки делятся на две группы: простые, или протеины, и сложные, или протеиды. Протеины состоят только из аминокислот, связанных в полипептидную цепь пептидными связями, а протеиды содержат кроме аминокислот небелковый компонент, или простетическую группу (углевод, липид, нуклеиновую кислоту, кофактор и т.д.). Белки имеют несколько уровней структурной организации: первичный, вторичный, третичный и в большинстве случаев четвертичный.
Присутствие веществ белковой природы в биологическом материале и лекарственных препаратах можно обнаружить с помощью качественных реакций на структурные компоненты белка и его функциональные группы. Все известные реакции выявления белков и пептидов можно разделить на три типа.
1. Реакция на пептидную группу, характерную для полипетидной цепи и нетипичную для прочих биологических веществ. Она специфична для белков и пептидов.
2. Реакции на концевые α-амино- или α-карбоксильные группы. Эти реакции дают также свободные α-аминокислоты и некоторые другие соединения.
3. Реакции на отдельные боковые радикалы или группы аминокислот, входящих в полипептиды. Эти реакции специфичны также и для свободных α-аминокислот и других веществ, содержащих соответствующую функциональную группу в молекуле.
Работа 1. Качественные (цветные) реакции на функциональные группы белков и аминокислот
Реактивы. Биуретовый реактив* (содержит NaOH и ионы Cu2+)[1], нингидрин, 0,5%-ный водный раствор; азотная кислота, конц.; гидроксид натрия, 20%-ный раствор; реактив Миллона*; уксусная кислота, ледяная; серная кислота, конц.; ацетат свинца, 5%-ный раствор; нитропруссид натрия, 5%-ный раствор.
Оборудование. Штатив с простыми пробирками; капельницы; пипетки вместимостью 1 мл; водяная баня.
Материалы для исследования.
1. Раствор яичного белка (белок одного куриного яйца отделяют от желтка, растворяют в 20-кратном объеме дистиллированной воды, фильтруют через несколько слоев марли и хранят в холодильнике).
2. Неразбавленный свежий яичный белок.
3. 1%-ные растворы глицина, глицилглицина, α-аланина, β-аланина.
4. 0,1%-ные растворы фенилаланина, тирозина, триптофана, гистидина, цистеина гидрохлорида, метионина.
а. Биуретовая реакция на пептидную группу (реакция Пиотровского). Метод основан на способности пептидной группы белков и полипептидов образовывать в щелочной среде с ионами Cu2+ комплексное соединение фиолетового цвета с красным или синим оттенком в зависимости от числа пептидных связей в белке.
Биуретовая реакция положительна с белками и пептидами, имеющими не менее двух пептидных связей (─ С ─NH ─). С ди- и трипептидами она
║
О
неустойчива. Биуретовую реакцию дают небелковые вещества, содержащие не менее двух пептидных групп, например, производное мочевины – биурет
H2N ─ C ─ NH ─C ─ NH2, давший название этой реакции, и некоторые
║ ║
O О
другие. В сильнощелочной среде пептидные группы полипептидов переходят в енольную форму, в которой и взаимодействуют с ионом Cu2+, образуя окрашенный биуретовый комплекс примерно следующего строения:
 |
На свободные аминокислоты биуретовая реакция обычно отрицательна. Исключение составляют гистидин, серин, треонин, аспарагин, которые при больших концентрациях в растворе могут образовывать окрашенный биуретовый комплекс Cu2+.
Ход определения. В одну пробирку вносят 5 капель ратсвора яичного белка, в другую – глицилглицина и в третью – глицина.
Добавляют в каждую пробирку по две капли биуретового реактива, слегка сбалтывают и наблюдают за появлением окрашивания.
б. Нингидриновая реакция на α-аминогруппу. Метод основан на взаимодействии нингидрина с α-аминогруппой аминокислот, пептидов, белков с образованием окрашенного комплекса синего или сине-фиолетового цвета.
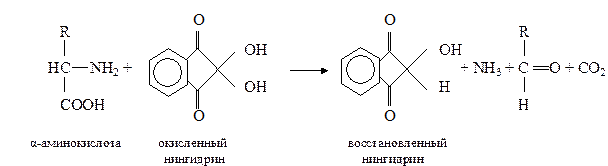
При нагревании в присутствии нингидрина происходит окислительное дезаминирование α-аминогрупп аминокислот и пептидов, а молекула нингидрина при этом восстанавливается:
Восстановленный нингидрин реагирует с аммиаком и другой молекулой окисленного нингидрина, в результате образуется окрашенное соединение (сине-фиолетовый комплекс Руэмана):
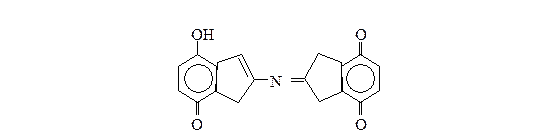 |
Пролин и оксипролин дают с нингидрином окрашенный продукт желтого цвета. Нингидриновая реакция может быть положительна с некоторыми аминами, амидами кислот и некоторыми другими соединениями.
Ход определения. В одну пробирку вносят 5 капель раствора яичного белка, в другую –α-аланина и в третью – β-аланина.
Добавляют в каждую пробирку по 2 капли раствора нингидрина, нагревают до кипения и через 1-3 мин наблюдают появление окрашивания.
в. Ксантопотеиновая реакция на ароматическое кольцо циклических аминокислот (реакция Мульдера). Метод основан на способности аминокислот и аминокислотных остатков полипептидов, содержащих ароматическое кольцо, образовывать при взаимодействии с концентрированной азотной кислотой динитропроизводные соединения желтого цвета. В щелочной среде они переходят в хиноидные структуры, имеющие оранжевое окрашивание.
Ксантопротеиновая реакция характерна для фенилаланина, тирозина и триптофана, имеющих ароматическое (бензольное) кольцо. Эти аминокислоты или содержащие их белки при нагревании с концентрированной азотной кислотой дают нитросоединения желтого цвета.
Например, в реакции с тирозином образуется динитротирозин; добавление гидроксида натрия приводит к образованию натриевой соли хиноидной структуры динитротирозина:
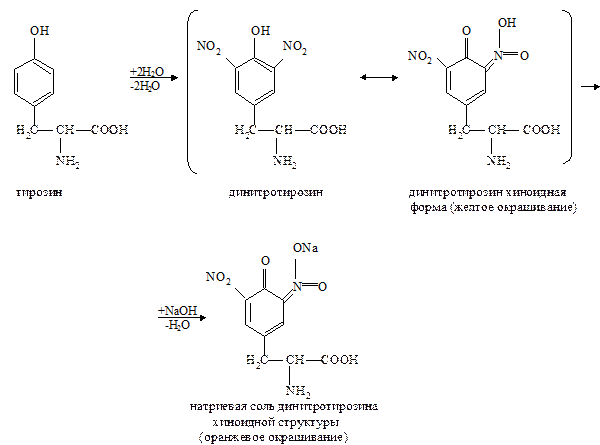 |
Ксантопротеиновая реакция положительна со многими ароматическими соединениями (бензол, фенол и др.).
Ход определения. 1.В одну пробирку вносят 5 капель раствора яичного белка, в другую – фенилаланина, в третью – тирозина и в четвертую – гистидина.
В каждую пробирку добавляют по 3 капли концентрированной азотной кислоты, нагревают до кипения (осторожно! В защитных очках!) и наблюдают за появлением окрашивания.
Содержимое пробирок охлаждают под струей водопроводной воды, затем в каждую по каплям добавляют раствор гидроксида натрия, пока не начнется переход окраски.
г. Реакция Миллона на тирозин. Метод основан на способности тирозина (как свободного, так и входящего в состав белка) при нагревании с реактивом Миллона образовывать ртутную соль нитротирозина, окрашенную в пурпурно-красный цвет:
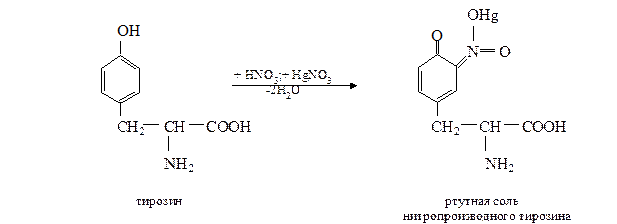
Эта реакция положительна также для фенольных соединений.
Ход определения. В одну пробирку вносят 5 капель раствора яичного белка, в другую – тирозина и в третью – фенилаланина. В каждую из них добавляют по 3 капли реактива Миллона и осторожно нагревают на водяной бане (не выше 50˚С), наблюдая за появлением окрашивания.
д. Реакция Адамкевича на триптофан. Метод основан на способности триптофана в кислой среде реагировать с глиоксиловой кислотой с образованием соединения, окрашенного в красно-фиолетовый цвет.
При нагревании две молекулы триптофана взаимодействуют с глиоксиловой кислотой с образованием окрашенного соединения:
 |
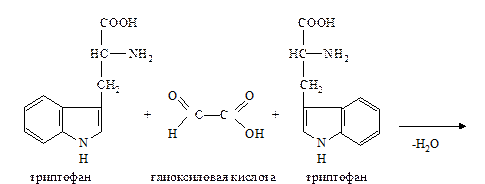
Для проведения реакции используют ледяную уксусную кислоту, в которой как примесь содержится глиоксиловая кислота. В качестве водоотнимающего средства в реакции используется концентрированная серная кислота.
Ход определения. В одну пробирку вносят 2 капли неразбавленного свежего яичного белка, а в другую – раствор триптофана.
Добавляют в каждую из них по 10 капель ледяной уксусной кислоты и осторожно нагревают до растворения выпавшего осадка белка в первой пробирке, после чего содержимое ее охлаждают.
Очень осторожно, по стенке, наклонив пробирку, подслаивают в каждую из пипетки около 1 мл концентрированной серной кислоты, следя за тем, чтобы жидкости не смешались. На границе двух слоев возникает характерное окрашенное кольцо, которое постепенно распространяется на весь раствор.
е. Реакция Фоля на аминокислоты, содержащие слабосвязанную серу (цистеин, цистин). Метод основан на способности белков, в состав которых входят серусодержащие аминокислоты (цистеин, цистин), в щелочной среде при нагревании образовывать сульфид натрия, который с плюмбитом натрия дает черный или бурый осадок сульфида свинца:
CH2 ─ SH CH2 ─ OH
│ │
CH ─ NH2 + 2NaOH → CH ─ NH2 + Na2S + H2O
│ │
COOH COOH
Pb(CH3COO)2 + 2 NaOH → Pb(OH)2 + 2CH3COONa
Pb(OH)2 + 2 NaOH → Na2PbO2 + 2H2O
Na2S + Na2PbO2 + H2O → PbS↓ + 4NaOH
Ход определения. В три пробирки наливают по 10 капель раствора ацетата свинца и по каплям в каждую из них прибавляют раствор гидроксида натрия до растворения первоначально образующегося осадка. В одну пробирку добавляют 5 капель раствора яичного белка, в другую – цистеина, в третью – метионина, смеси кипятят 1-2 мин и наблюдают за изменением их цвета и выпадением осадка.
ж. Нитропруссидная реакция на серусодержащие аминокислоты. Метод основан на способности сульфида натрия, образующегося щелочном гидролизе серусодержащих аминокислот, давать с нитропруссидом натрия окрашенное комплексное соединение красно-фиолетового цвета:
1. H2C ─ SH H2C ─ OH
│ кипячение │
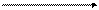 HC ─ NH2 + 2NaOH HC ─ NH2 + 2Na2S + H2O
HC ─ NH2 + 2NaOH HC ─ NH2 + 2Na2S + H2O
│ │
COOH COOH
цистеин серин
Na2S + Na2[Fe(CN)5NO] → Na4[Fe(CN)5NOS]
нитропруссид окрашенный
натрия комплекс
Ход определения. В одну пробирку вносят 5 капель неразбавленного свежего яичного белка, в другую – раствор цистеина, в третью – метионина. Добавляют в каждую пробирку по 10 капель раствора гидроксида натрия, кипятят 3 мин и затем охлаждают их содержимое.
В каждую пробирку прибавляют 2-3 капли раствора нитропруссида натрия и наблюдают за появлением окрашивания.
Оформление работы. После каждой реакции сделать вывод о ее специфичности для исследуемого вещества и присутствии соответствующих функциональных групп в яичном белке. Результаты оформить в виде таблицы, отмечая знаками «плюс» или «минус» результат реакции.
| №№ п/п | Исследуемый материал | Реакция | ||||||
| Биуретовая | Нингидриновая | Ксантопротеиновая | Фоля | Миллона | Адамкевича | Нитропруссидная | ||
Практическое значение работы. Качественные реактивы (или, как их часто называют, цветные реакции) используются в клинико-биохимических лабораториях, фармацевтической практике и биохимических исследованиях для обнаружения присутствия белка и аминокислот в биологических средах, качественного анализа белковых лекарственных средств, препаратов гидролизатов белков и аминокислот, пептидов и белков на хроматограммах и электрофореграммах. Многие качественные реакции положены в основу методов количественного определения белков и аминокислот.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 4322; Нарушение авторских прав?; Мы поможем в написании вашей работы!