
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хронокондуктометрия 18 страница
|
|
|
|
Комплексонометриялық титрлеу. Катиондарды комплексон ІІІ (ЭДТА) ерітіндісімен потенциометриялық әдіспен титрлеу процесін, индикатор электроды ретінде сәйкес металды қолдана отырып жүргізуге болады. Мысалы, мыстың тұздарын мыс электродымен, мырыш тұздарын – мырыш электродымен, т.т. немесе сәйкес ион-селективті электродтарды пайдаланады. Дегенмен, көптеген металдық индикаторлық электродтар қайтымсыз, ал ион-селективті электродтардың саны шектеулі.
Комплексонометриялық титрлеу үшін универсалды индикаторлар Hg/HgY2- немесе Au(Hg)/HgY2- қолданылуы мүмкін. Мұндағы Au(Hg) – амальгаммаланған алтын, HgY2- - сынаптың этилендиаминтетрасірке қышқылының анионымен түзген комплексі. Мысалы, кальций иондарын титрлеу кезінде, мынадай тізбек жинайды:
Hg½Hg2Cl2, KCl½ Ca2+, HgY2- (10-4)½Hg
Cынаптың тұрақты комплексонаты (lgbHgY2-=21,8) аз дәрежеде иондарға диссоциацияланады:
HgY2- = Hg2+ + Y4-
Осыдан сынап электродының потенциал мәнін анықтайды:
ЕHg2+½Hg = E0Hg2+½Hg + 0,029 lg[Hg2+]
Немесе HgY2- комплексінің жоғарыдағы схемасы бойынша диссоциациялануын ескерсек,

мұндағы bHgY2- - HgY2- комплексінің тұрақтылық константасы.
Титрлеу кезінде түзілген СаY2- комплексонаты bСаY2- тұрақтылық константасымен сипатталады:

Бұл теңдеуден [Y4-] тауып, оны алдыңғы теңдеуіне қоямыз, сонда:
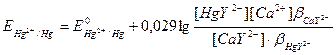
немесе

HgY2- және СаY2- комплекстерінің концентрациясы эквиваленттік нүктеге жақындағанда өте аз өзгереді. Осы теңдеудің алғашқы екі қосылғышын const деп алсақ, онда мынадай теңдеу аламыз:
ЕHg2+½Hg = const + 0,029 lg [Ca2+]
Бұл теңдеуден сынап электродының HgY2-½Hg потенциалы Са2+ иондарына сезімтал екендігін байқауға болады. Эквиваленттік нүкте аймағында потенциалдың күрт өзгеруі байқалады, осының нәтижесінде титрлеу секірісі пайда болады. Сынап электроды мен Y2- анионының көмегімен көптеген иондарды, мысалы, Al3+, Mn2+, Sr2+, Ba2+, Cd2+, Pb2+, Mg2+, Ca2+, Co2+, Nі2+, Cu2+, Zn2+ және тағы басқа катиондарды анықтауға болады. Этилендиаминтетра сірке қышқылының артық мөлшердегі ерітіндісі стандартты Hg(NO3)2 ерітіндісімен титрленеді.
Комплексонометриялық титрлеуде платина электродын пайдаланып Со2+, Сu2+, Tl3+ иондарын анықтауға болады.
Тұндыру әдісі бойынша титрлеу. Тұндыру реакциялары қолданылатын потенциометриялық титрлеу әдісінде индикаторлық электрод ретінде металл немесе мембраналық электродтар пайдаланылады. Бұл электродтар анықталынатын иондар мен ион-тұндырғыштарға сезімтал келеді. Тұндыру әдісі бойынша күміс, сынап, мырыш, қорғасын катиондары, хлор, бром, иод және тағы басқа аниондар анықталады. Галогенидтердің қоспасы, мысалы І- және Cl- иондарын, күміс нитратымен оларды бөлмей-ақ титрлеуге болады:
Ag+ + Cl- «AgCl
Индикаторлық күміс электроды күміс иондарына селективті.
Осындай титрлеу барысында күміс электродын пайдалану екі титрлеу секірісін тіркеуге мүмкіндік береді. Бірінші титрлеу секірісі, иодид-ионының титрленіп болғанын дәлелдейді және оның сандық мөлшерін есептеуге қолданылады, ал екінші титрлеу секірісі хлорид-ионының тұнбаға түсіп болғанын көрсетеді. Егер бірінші титрлеу секірісіне дейін иодид-ионының концентрациясы белгілі болса, онда екінші титрлеу секірісі бойынша галогенидтердің жалпы қосындысының мөлшерін есептеуге немесе хлорид-ионының концентрациясын анықтауға болады.
Титрлеу барысында рAg өзгерісі, AgCl тұнбасының түзілуі І-ионы бойынша эквиваленттік нүктеге жеткенше жүретінін көрсетеді.
Тотығу-тотықсыздану титрлеу әдісі. Потенциометриялық титрлеу әдісі редоксиметрияда да кеңінен қолданылады. Бұл әдіс бойынша тотықтырғыштар немесе тотықсыздандырғыштар қоспасын бір титрантпен анықтауға болады. Қоспаларды титрлеу мүмкіндігі мен эквиваленттік нүктені анықтау дәлдігі мұнда да эквиваленттік нүкте кезіндегі DЕ мәніне байланысты. Оның мәні реагенттердің редокс-потенциалдарына, сондай-ақ әрбір молекуланың қосып алатын немесе беріп жіберетін электрон санына да тәуелді.
Тотығу-тотықсыздану титрлеу әдісінде электрод ретінде инертті металл электроды, ал салыстыру электродының қызметін каломельді электрод атқарады. 21.2-суретте Ғе2+ ионын церий (ІV) ионымен төмендегі реакция бойынша
Fe2+ + Ce4+ «Fe3+ + Ce3+
потенциометриялық титрлеудің схемалық бейнесі және титрлеу қисығы көрсетілген.
Потенциометриялық тотығу-тотықсыздану әдісінде темір сульфаты (ІІ) жиі қолданылады, мысалы хром мен ванадийді аммоний персульфатымен тотықтырып алып, ҒеSO4 ерітіндісімен титрлейді:
K2Cr2O7 + 6FeSO4 + 7H2SO4 =K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O
2HVO3 + 2FeSO4 + 3H2SO4= 2VOSO4 + Fe2(SO4)3 + 4H2O
Cондай-ақ, хроматтарды ванадаттар қатысында анықтау үшін натрий арсенитінің ерітіндісі пайдаланылады, өйткені ванадаттар тотықсызданбайды. Күшті тотықсыздандырғыш болып табылатын – титан (ІІІ) тұзын темір мен мыс қоспасын анықтауда пайдаланады: алдымен темір (ІІІ) ионын екі валентті күйге өткізеді, осыдан кейін мыс (ІІ) ионын бір валентті күйге дейін тотықсыздандырады. Мұнан басқа күшті тотықсыздандырғыштарды пайдаланып, мысалы, хром немесе қалайы (ІІ) тұздары қолданылатын титрлеу әдістері де бар, бірақ мұндай анализ кезінде ауадағы оттегінің әсерінен біраз қиындықтар туындауы мүмкін. Қалайы (ІІ) хлориді молибденді (VІ) молибден (V) ионына дейін, ал ванадийді (V) ванадиий (ІІІ) ионына дейін тотықсыздандырады. Осыған байланысты екі элементті де бір-бірінің қатысында анықтауға болады.
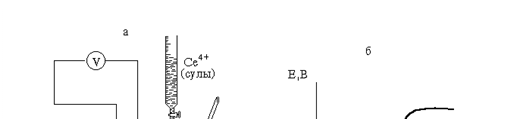 |
21.2-сурет. Потенциометриялық титрлеу қондырғысы және титрлеу қисығы
Тотығу-тотықсыздану әдісінде (редоксиметрияда) титрлеу қисығын рМе=-lg[СМеn+] жағдайында рМе –V немесе Е –V координатында тұрғызуға болады (мұндағы: [СМеn+] –реакцияға қатысушы металл ионының концентрациясы, Е – жүйенің потенциалы, V – титрант көлемі). Индикаторлық электрод ерітіндідегі Ме ионына сезімтал болған жағдайда, титрлеу қисығының алғашқы түрі үлкен мәнге ие. Екінші тәуелділік бойынша тұрғызылған қисық түрі жиі қолданылады.
Платина-индикаторлы электроды пайдаланылатын титрлеудің кез келген тотығу-тотықсыздану әдісі потенциалдың (Е) өзгерісі бойынша жүзеге асады.
Тотығу-тотқсыздану және қышқылды-негіздік титрлеу әдістерін жүргізу үшін түсті индикаторлар да пайдаланылуы мүмкін.
Бақылау сұрақтары:
1.Потенциометриялық анализ әдісінің негізі.
2.Потенциометриялық титрлеу әдісінің түрлері.
3.Ионселективті электродтар.
4.Металдық электродтар.
5.Хингинронды электрод.
6.Потенциометриялық титрлеуде қолданылатын реакциялар түрлері және оларға қойылатын талаптар.
7.Потенциометриялық анализ әдісінің артықшылықтары және кемшіліктері. Мысал келтіріңіз.
Пайдаланған әдебиеттер:
20. Алексеев В.Н. Количественный анализ М.: Химия, 1974
21. Воскресенский А.Г., Семиколенов Г.Ф., Солодкин И.С. Сборник задач и упражнении по аналитической химии. М.: Высшая школа, 1985.
22. Дорохова Е.Н., Прохова Г. В. Аналитическая химия. Физико –химические методы анализа. М.: Высшая школа, 1991
23. Захарова Э.А. Обработка результатов химического анализа. Томск.: Изв-во Томск. Уни-та, 1984
24. Крешков А.П. Основы аналитической химии. М.: Химия, 1971, т. 1,2.
25. Логинов Н. Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. М.: Химия, 1979.
26. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989.
27. Пономарев В.Д. Аналитическая химия 2ч. М.: Высшая школа, 1982
28. Фритц Дж., Шенк Г. Количественный анализ М.: Высшая школа, 1978
29. Чарыков А.К. Математическая обработка результатов химического анализа. Методы обноружения и оценок ошибок. Л.: Химия, 1984
30. Ярославцев А.А. Сборник задач и упражнений по аналитической химии. М.: Высшая школа, 1979
№ 5 Лекция тақырыбы: Потенциометриялық титрлеуде қолданылатын реакцияларға қойылатын талаптар.
Сабақтың жоспары:
1. Потенциометриялық тұндырып титрлеу әдісі
2. Ионометрия.
Сабақтың мақсаты: Потенциометриялық анализ әдісінің теориялық негізін оқыту.
Потенциометриялық титрлеуде қолданылатын реакцияларға мынадай талаптар қойылады:
- реакция міндетті түрде стехиометриялық қатынаста жүруі керек;
- негізгі химиялық және индикаторлық реакциялар тепе-теңдігі жылдам орнауы керек;
- зерттелінетін реакция үшін, яғни анықталынатын немесе онымен әрекеттесетін заттардың концентрациясының өзгерісіне сезімтал электрод дұрыс таңдалуы керек;
- ерітіндіде қосымша реакциялар жүрмеуі керек;
Өте баяу жүретін реакциялар үшін кері титрлеу әдісін қолдануға болады. Реагенттің артық мөлшерін қосу тепе-теңдіктің жылдам орнауын қамтамасыз етеді. Реагенттің артық мөлшері арнайы таңдалынып алынған титрант көмегімен сәйкес индикаторлық электрод қатысында кері титрленеді. Кері титрлеу әдісі, анықталынатын зат пен реагенттің химиялық реакциясының тепе-теңдігін ығыстырмайтын болса ғана қолданылады.
Табиғи судың рН-ын анықтау
Табиғи судың құрамында НСО3-, СО32-, ОН- аниондары болатындықтан, оның ортасы сілтілік реакцияға ие. Судың рН мәнін потенциометриялық анықтауда - судың түсі (боялуы), тотықтырғыштар мен тотықсыздандырғыш-тардың, жүзінділердің болуы және жоғары концентрациялы тұздардың болуы кедергі жасамайды.
Жұмыстың орындалуы: Жұмыс бастар алдында шыны электродын суда немесе әлсіз қышқыл ерітіндісінде ұстайды.
Прибордың дұрыстығын буферлік ерітінділер бойынша келесі реттілікпен тексереді: стаканға буферлік ерітіндінің біреуінен (мысалы, рН=4,01) құйып, оған электродтарды батырып, электродтарды приборға жалғайды. Приборды рН өлшеуіш диапазонына қосады. Температура көрсеткіш корректорды қажетті температураға сәйкестендіріп, приборды берілген буферлі ерітіндінің рН мәні бойынша тексереді. Осылайша приборды келесі буферлік ерітінділердің рН мәндері бойынша тексереді. Буферлік ерітіндіге әрбір батырған сайын электродтарды жақсылап дистилденген сумен шайып, сүзгі қағазымен құрғатады. Прибор шкаласы бойынша рН-ты өлшеу 0,5-1 минут сайын жүргізіледі.
Стаканға зерттелінетін судың сынамасынан алады, оған шайылған және құрғатылған электродтарды батырып, рН-ын өлшейді.
Сутегі және гидроксил-иондарының концентрациясын (моль/л) есептейді: [H+] = 10-pH, [OH-] = 10pH-pKw
Иодиттер мен хлоридтер қоспасын анықтау
Галогенидтер қоспасынан тұратын ерітіндіні потенциометриялық әдіспен титрлеуде, стандартты AgNO3 ерітіндісін пайдаланып, классикалық компенсациялық әдіспен жүргізеді. Гальваникалық элементтің ЭҚК индикаторлық күміс электроды мен салыстырмалы қаныққан к.э. арқылы өлшенеді.
Еқанық.к.э > Е0AgІ/Ag,І- болғандықтан, І- иондарын титрлеу кезінде индикаторлық электродты потенциометрдің теріс таңбалы клеммасына, ал қаныққан к.э. – оң таңбалы клеммасына жалғайды. Йодид-иондары толығымен титрленіп болған соң, реакция Сl- және Ag+ иондары арасында жүре бастайды. Осының салдарынан индикаторлық электродтың потенциалы қаныққан к.э. потенциалымен салыстырғанда едәуір оң мәнге қарай ығысады. Бұл жағдай электродтарды сәйкес клеммаларға ауыстырып жалғауды қажет етеді.
Галогенидтерді титрлеу кезінде гетерогенді жүйе пайда болатындықтан, индикаторлық электродтың тепе-теңдік потенциалы титрлеудің соңғы нүктесінде (т.с.н.) уақыт өте орнайды. Бұл - тұнбаның түзілу жылдамдығының әсерінен, кристалдардың өсуінен, тұнбадағы иондардың қайта топтасуынан, адсорбция, десорбция әсерінен және тағы басқа себептерден болуы мүмкін. Сондықтан өте дәл титрлеу кезінде т.с.н. маңында потенциометрдің әрбір көрсетуін жазып алады және титранттың жаңа порциясы тізбектегі ЭҚК тұрақтанғанда ғана қосылады (ЭҚК өзгерісі 5-10 мВ/мин аспауы тиіс).
Сондай-ақ, титрлеу процесі кезіндегі І- иондарының AgІ тұнбасына адсорбциялануын ескерген жөн. Сондықтан, анықтаудың өте дәл нәтижелерін алу үшін титрлеуді күшті электролит қатысында жүргізу қажет. Әдетте, Ва(NO3)2 немесе Ba(CH3COO)2 ерітінділері алынады, бұл электролиттер галогенидтердің адсорбциялануын тежейді.
Жеке хлорид иондарын немесе оның басқа галогенидтермен қоспасын титрлегенде, қаныққан KNO3 немесе K2SO4 ерітіндісімен толтырылған тұз көпіршесі пайдаланылады. Ескерту: КСІ ерітіндісімен толтырылған тұз көпіршесін алуға болмайды, себебі титрленетін ерітіндіге көпіршеден СІ- иондары ерітіндіге диффузиялануы мүмкін.
Жұмыстың орындалуы: Зерттелінетін ерітіндінің аликвоттық бөлігін титрлеуге арналған колбаға құйып, үстіне дәл сондай көлемде 10%-тік Ва(NO3)2 немесе Ba(CH3COO)2 ерітіндісінен құяды.
Әрбір титрлеудің алдында индикаторлық электродтың бетін күміс галогенидтері қабатынан тазартып отыру керек. Ол үшін электродты 10%-тік аммиак немесе концентрлі Na2S2O3 ерітіндісіне батырып, соңынан дистилденген сумен жақсылап шаяды. Осыдан кейін электрод бетін ақырын сүзгі қағазымен сүртіп, дистилденген сумен қайта шаяды. Күміс электродының бетін регенерациялау үшін оны жиі-жиі аздаған уақытқа (5-10 секундқа) КNO3 кристалдары салынған HNO3 ерітіндісіне (1:1) батырып отырады. Индикаторлық күміс электродын азот қышқылында бақылаусыз қалдыруға өте қатаң тиым салынады. Осылайша өңделген электродты ағын сумен мұқият жуады, соңынан дистилденген сумен шаяды.
Қаныққан КСІ ерітіндісі құйылған стаканға қаныққан к.э. батырылады. Титрленетін ерітіндінің хлорид-иондарымен ластануын болдырмас үшін тізбекке қаныққан KNO3 немесе K2SO4 ерітіндісімен толтырылған тұз көпіршесін жалғайды. Тұз көпіршесінің белгі салынған бөлігі КСІ ерітіндісіне батырылады. Осы операцияларды мұқият орындағаннан кейін титрлеуге кіріседі.
Алдын ала титрлеу нәтижесінде, екі титрлеу секірісін байқап алғаннан кейін, өте дәл титрлеуге кіріседі. Потенциалдың қос секірісі пайда болатын аймақта титрантты 2 тамшыдан қосады.
Бірінші потенциал секірісіне жауап беретін титрант көлемі V1, ерітіндідегі І- индарының мөлшерін есептеуге мүмкіндік береді. Екінші потенциал секірісі бойынша анықталған титранттың жалпы көлемі V2 – І- және СІ- иондардарының қосынды мөлшеріне сәйкес келеді. Осыдан V2 - V1 арасындағы айырмашылық, ерітіндідегі СІ- иондарының мөлшерін береді.
Галогенидтерді анықтау жұмысы аяқталғаннан кейін, титрленетін ерітіндіге батырылған тұз көпіршесінің ұшын Na2S2O3 немесе аммиак ерітіндісімен шайып, соңынан дистилденген сумен жуады.
Бақылау сұрақтары:
1. Электр қос қабаты.
2. Электрод потенциалының пайда болуы.
3. Электрохимияның негізгі заңдары.
4. Электродтар классификациясы, электродтар түрлері.
5. Ионометрия. Ионселективті электродтар.
6. Хингинронды электрод.
7. Потенциометриялық титрлеуде қолданылатын реакциялар түрлері және оларға қойылатын талаптар
№ 8 Лекцияның тақырыбы: Кулонометриялық анализ әдісі
Сабақтың жоспары:
1. Әдістің теориялық негізі
2. Тұрақты электрод потенциалын-дағы кулонометрия
Сабақтың мақсаты:
Кулонометриялық титрлеу қондырғысының конструкциясымен танысып, генератор электродында синтезделінген электроактивті титранттар арқылы ерітінділер концентрациясын анықтау тәсілімен танысу.
Кулонометриялық анализ әдісі электрохимиялық ұяшықтан өткен электр тогының мөлшерін өлшеуге негізделген. Сондықтан электролиз кезінде түзілген өнімнің массасын емес, электродтық реакция кезінде жұмсалған электр мөлшері өлшенеді. Электрондардың, анықталынатын зат иондарымен (молекуласымен) әрекеттесуі стехиометриялық қатынаста, яғни жанама заттардың кері әсерінсіз жүзеге асуы керек. Реакцияның стехиометриялығын тексеру үшін әдетте, ток бойынша шығым 100% болуы тиіс.
Фарадей заңы бойынша, электролиз нәтижесінде түзілген зат массасы электрохимиялық ұяшықтан өткен электр мөлшеріне пропорционал:
m = q Q мұндағы Q = Іt және q=A/nF.
m – электрохимиялық өзгеріске ұшыраған зат салмағы, г;
А – заттың молекулалық, атомдық немесе иондық салмағы;
Q – электр мөлшері, ол электролиз кезіндегі ток күші І (А) мен электролиз уақытының t (секунд) көбейтіндісіне тең;
n - заттың бір ионының, атомының немесе молекуласының электрохимиялық тотығу немесе тотықсыздану реакциясына қатысатын электрон саны;
Ғ - Фарадей саны, 96 490 кулон, 1г-экв заттың электрохимиялық өзгерісіне қажетті электр мөлшері;
Бұл теңдеу арқылы басқа параметрлер белгілі болған жағдайда, зат массасы (m) бойынша n, Q, M немесе F мәндерін анықтауға болады.
Қазіргі таңда кулонометриялық әдістерде электр мөлшерін анықтау үшін интегралдау тәсілін қолданады. Электролиз кезіндегі белгілі ток күшінде бұл мәнді уақыт бойынша интегралдау тәсілімен табуға болады:
Q = z Іdt
Ерітіндіде жүретін электрохимиялық процестерге тәуелді кулонометриялық анализ тура кулонометрия және жанама кулонометрия немесе кулонометриялық титрлеу деп жіктеледі. Бұл әдістердің әрқайсысының өзіне тән ерекшеліктері, жетістіктері мен кемшіліктері бар. Дегенмен, барлық кулонометриялық әдістер мынадай талаптарды қанағаттандыруға міндетті: анализденетін заттың электрлік өзгерісі 100%-тік ток бойынша шығыммен жүзеге асуы тиіс; электрохимиялық немесе химиялық (жанама кулонометрия) реакциялардың аяқталу сәтін дәл анықтайтын тәсілдерінің болуы; бақыланатын реакцияның толығымен аяқталу сәтіне дейін ұяшықтан өткен электр мөлшерін дәл анықтау (Q).
Тура кулонометрияда жұмысшы электродында жүретін электрохимиялық реакцияға (мысалы, А + ne ® B - тотықсыздану немесе В – ne ® А - тотығу) жұмсалған электр мөлшерін, яғни осы реакциялардың толық жүруі кезінде қатысқан жалпы электрон санын анықтай отырып және А немесе В заттарының n және А мәнін біле отырып, олардың мөлшерін тікелей табуға болады.
Сондай-ақ мынадай жағдайды қарастыруға болады: А және В заттары электрод реакцияларына қатыспайтын болса, онда бұл ерітіндіге осы жағдайда D–me®Z немесе Z+me®D реакциялары бойынша электродта тотығатын не тотықсыздана алатын затты қосады. Осы реакцияның кез келген өнімі (Z, D немесе басқа) анықталынатын А немесе В затымен химиялық стехиометриялы әрекеттесуге қабілетті. Сонда Z немесе D өнімдерінің түзілуіне жұмсалған электр мөлшері, ерітіндідегі В немесе А мөлшеріне эквивалентті, сондықтан соңғыларының салмағын оңай есептеп табуға болады. Бұл тәсіл жанама кулонометрия деп аталады.
Кулонометриялық анализ әдісі m=qQ қатынасын қолданып, электрохимиялық реакцияға 100%-тік ток бойынша шығыммен қатысатын кез келген заттың сандық мөлшерін анықтауға мүмкіндік береді. Ток бойынша шығымды есептеу үшін ток күшін (І) өлшейді және q = Іt формуласы бойынша электр мөлшерін тауып, осы формула бойынша электродтық реакция өнімінің теориялық салмағын (mтеор) есептейді. Бұл табылған мәнді эксперимент жүзінде табылған салмақпен (mэксп) салыстырады. Егер mтеор/ mэксп < 1 (<100%) болса, онда электр тогы қосымша жүретін электродтық реакцияларға да жұмсалғаны, сондықтан кулонометриялық анықтаулар жүргізу мүмкін емес. Мұндай жағдайда тәжірибені жүргізу шартын өзгерту керек және 100 %-тік ток бойынша шығым алуға мүмкіндік туғызады.
Жоғарыда көрсетілген кулонометриялық анализ әдістері орындалу техникасына байланысты негізгі екі түрге бөлінеді: тұрақты потенциалдағы кулонометрия (потенциостатикалық кулонометрия) – Е=const және тұрақты ток күшіндегі кулонометрия (кулонометриялық титрлеу) – І=const.
Тұрақты электрод потенциалындағы кулонометрия
Бұл әдісте қажетті электродтық реакция жүзеге асатын электрод потенциалы арнаулы қондырғы - потенциостат аспабы көмегімен автоматты түрде тұрақты етіліп ұсталады (тура потенциостаттық кулонометрия - ТПК). Берілген электродтық реакция үшін қажетті потенциалды таңдау і-Е тәуелділігі бойынша жүргізіледі.
Тұрақты потенциалда электрохимиялық ұяшықтан өтетін ток, тотықсызданатын зат концентрациясының өзгеруіне тәуелді, сондықтан
Ct /C0 = Іt /І0 =10-kt
теңдеуіне сәйкес реакцияның жүруі кезінде азаяды:
Іt = Іoe-kt
Мұндағы І0 – бастапқы сәттегі, ал Іt – t уақыт өткендегі токтар; k – сандық мәні бірқатар факторларға (мысалы, фазаның жанасу бетінің размеріне, араластыру интенсивтілігіне, температураға) тәуелді болатын коэффициент.
Жұмсалған электр мөлшерін соңғы теңдеу бойынша графиктік түрде интегралдау арқылы анықтауға болады. Көп жағдайларда осындай мақсатта электрохимиялық кулонометрлерді қолданған тиімді. Мұндай кулонометрлер электролиттік ұяшықпен тізбектесе жалғанады. Осы кезде кулонометрден өтетін токтың мөлшері, электролиттік ұяшықтан өтетін ток мөлшеріне тең. Егер кулонометрде мысалы, күміс нитратының ерітіндісі бар болса, онда оның катодында күміс бөлінеді. Бөлінген күмістің салмағы бойынша m = qQ формуласының көмегімен электр мөлшерін Q есептейді.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1280; Нарушение авторских прав?; Мы поможем в написании вашей работы!