
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хронокондуктометрия 21 страница
|
|
|
|
Мысалы, 0.1 М сульфат ерітіндісінен мыс және мырыш металдардын бөліп алуды қарастырайық. Аталған металдардың стандартты электродтық потенциалдарының мәндері Е0Cu2+/Cu = 0.345B, E0Zn2+/Zn=-0,764B. Нернст теңдеуі бойынша ерітіндіден мыс пен мырыштың бөліну потенциалдарын есептеп табуға болады:
Мыс үшін катод потенциалы
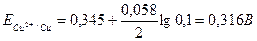
Мырыштың бөлінуі үшін
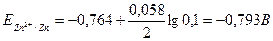
Егер Сu2+ иондарының ерітіндідегі концентрациясы 10-6 моль/л немесе одан аз болса, онда бұл жағдайда катод потенциалы
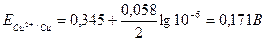
Бұл потенциал мәнінде мырыштың бөлінуі басталмайды, сондықтан мысты сульфат-ерітінділерінен мырыш қатысында оңай бөліп алуға мүмкіндік туады.
Сондай-ақ мырыштың бөліну потенциалы кезінде Cu2+ иондарының концентрациясын анықтауға да болады:
-0.793 = 0,345 + 0,029 lg [Cu2+],
бұдан
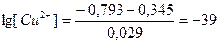 , яғни [Cu2+] = 10-39 моль/л
, яғни [Cu2+] = 10-39 моль/л
Анодта оттегі бөлінеді: Н2О – 2е = 1/2 O2 + 2H+
Осыған сәйкес ерітіндінің қышқылдылығы артады.
[H+]=1 моль/л кезіндегі анод потенциалын Нернст теңдеуі арқылы анықтауға болады:
ЕO2 /H2O = 1,23 + 0,058 lg 1 = 1,23B
Оттегінің аса кернеулігі, мысалы тегіс платина электродында 0,001 А/см3 кезінде 0,78 В құрайды. Осыдан оттегінің аса кернеулігін ескергенде анод потенциалы мынаған тең:
1,23 + 0,78 = 2,01 B
Егер потенциал кездейсоқ өзгерістер нәтижесінде өзгеретін болса, онда сутегі бөліне бастайды. Сутегінің бөлінуін болдырмас үшін мысты анықтау кезінде анализденетін ерітіндіге аздап азот қышқылын қосады. Катодта NO3- иондары NO2- ионына дейін (Е0NO3-/NO2- =0,94В) немесе NH4+ ионына дейін (Е0NO3-/NH4+ = =0,87 В) тотықсызданады.
Осылайша, ерітіндіде нитрат-иондары бар болғанда, катодта сутегі бөлінбейді. Қажет емес электродтық процестерді болдырмау мақсатында ерітіндіге қосылатын осындай заттар деполяризаторлар деп аталады. Әдетте олар белгілі бір потенциалға дейін әсерін жоймайды. Осы жағдайдағы деполяризатор катодтық процестерге ғана әсерін тигізетіндіктен, нитрат ионы – катодтық деполяризатор болып табылады.
Анодтық деполяризаторлар қажет емес анодтық процестерді болдырмайды. Мысалы, қорғасынның анодта PbO2 түрінде бөлінуін жою үшін Pb2+ иондары бар ерітіндіге гидразин қосу керек. Гидразин қышқыл ортада Pb2+ иондарына қарағанда өте төмен анодтық потенциалда тотығады.
Бақылау сұрақтары:
1.
Пайдаланған әдебиеттер:
75. Алексеев В.Н. Количественный анализ М.: Химия, 1974
76. Воскресенский А.Г., Семиколенов Г.Ф., Солодкин И.С. Сборник задач и упражнении по аналитической химии. М.: Высшая школа, 1985.
77. Дорохова Е.Н., Прохова Г. В. Аналитическая химия. Физико –химические методы анализа. М.: Высшая школа, 1991
78. Захарова Э.А. Обработка результатов химического анализа. Томск.: Изв-во Томск. Уни-та, 1984
79. Крешков А.П. Основы аналитической химии. М.: Химия, 1971, т. 1,2.
80. Логинов Н. Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. М.: Химия, 1979.
81. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989.
82. Пономарев В.Д. Аналитическая химия 2ч. М.: Высшая школа, 1982
83. Фритц Дж., Шенк Г. Количественный анализ М.: Высшая школа, 1978
84. Чарыков А.К. Математическая обработка результатов химического анализа. Методы обноружения и оценок ошибок. Л.: Химия, 1984
85. Ярославцев А.А. Сборник задач и упражнений по аналитической химии. М.: Высшая школа, 1979
№15 Лекция тақырыбы: Гальваностатикалық электролиз режиміндегі электрогравиметрия
Сабақтың жоспары:
1. Гальваностатикалық электролиз режиміндегі электрогравиметрия
2. Электрогравиметриялық анализдің қолданылуы
Сабақтың мақсаты:
Ток күшін тұрақты етіп электролиз жүргізу әдісі элементтерді сандық бөлуде және оларды концентрлеуде жиірек қолданылады. Анықталынатын элементті ерітіндіден бөліп алу шарасына байланысты электролиз кезіндегі катод потенциалының өзеруіне қарай токты біртіндеп төмендетеді. Гальваностатикалық режимді қолдану анықталынатын микроқоспалардың разрядталу потенциалына қарағанда едәуір оң электрлі макрокомпоненттерді бөліп алуда, мысалы, мыстағы, висмуттағы және қорғасындағы микроқоспаларды анықтауда тиімдірек.
Катодта сутегінің бөлуінін болдырмау үшін катодтық деполяризаторлар, мысалы, NO3- қолданылады.
Іштей электролиз әдісі
Кейбір жағдайларда электроаналитикалық анықтауларды сыртқы ЭҚК қатысынсыз-ақ, іштей электролиз деп аталатын әдіс бойынша жүргізуге болады. Бұл әдіс гравиметриялық анализдің бір түріне жатады және ол негізгі металл құрамындағы аз мөлшердегі бөгде металл қоспасын анықтауда қолданылады. Мұнда түзілетін сәйкес гальваникалық элементке анықталынатын металл ионы қатысады. Іштей электролиз әдісі ертеректен белгілі болғанымен, әдістің қарапайым диафрагмасыз вариантын Ю.Ю.Луре жетілдірген. Әдістің “іштей электролиз” деп аталуы сыртқы ток көзін пайдаланудан шыққан.
Іштей электролиз әдісі ерітіндіге (мысалы, құрамында аздаған мыс тұзының қоспасы бар ZnSO4 ерітіндісі) гальваникалық жұпты құрайтын екі электродты батырғанда (мысалы, Zn және Pt) электр тогының пайда болуына негізделген. Электр тогы айтылған жағдайда мырыш және платина электродтары потенциалдарының арасындағы айырмашылықтан туындайды. Токтың пайда болу процесі химиялық өзгерістер арқылы жүзеге асады, нәтижесінде платина электродында анықталынатын металл (мысалы, мыс) Cu2+ иондарының тотықсыздануы нәтижесінде тұнбаға түседі, ал мырыштың эквивалентті мөлшері тотығу салдарынан Zn2+ иондарын түзе ерітіндіге өтеді. Осы кезде мырыш электроды босап шыққан электрондар есебінен теріс зарядқа ие болады. Электрондар, сондай-ақ платина электродына да өтеді де, оның бетінде ерітіндідегі мыс иондары зарядсыздана бастайды. Осы құбылыс цементациялану деп аталады. Платина электродында мыс иондарының разрядталуы едәуір жеңілдейді. Сондай-ақ мыс ионының тек платина электродында ғана тұнуын қамтамасыз ететін жағдайды (ерітінді қышқылдылығы, температура, анықталынатын қоспа мен негізгі компоненттің қажетті концентрациясы) таңдап алуға болады. Біраз уақыттан кейін мыс тұнбасы отырған платина катодын ерітіндіден шығарып, мырыш анодынан ажыратады, жуады, кептіреді, соңында таразыда өлшейді.
Платина катодында бөлінетін металдар еритін металл-анодқа қарағанда едәуір оң электрлік потенциалға ие болуы керек. Сондықтан іштей электролиз әдісі әр түрлі металл анодтарын пайдаланып, бірқатар металдардың қоспасын бөліп анықтауда қолданылады.
Іштей электролиз әдісінің жетістігіне - қолданылатын қондырғының қарапайымдылығы жатады. Электролиттік тұндырудың басқа әдістеріндегі тәрізді, металдардың кернеулік қатары - элементтер қоспасын іштей электролиз әдісі арқылы бөліп алуды шектеуші фактор болып табылады. Іштей электролиз әдісі арқылы электрлік потенциалы азырақ оң металл құрамындағы электрлік потенциалы көбірек оң болып келетін қоспаларды анықтауға болады, мысалы, кадмийдегі мысты анықтауға болады, бірақ керісінше етуге болмайды.
Іштей электролиз әдісінің кемшілігі – анықталынатын компоненттердің үлкен мөлшерін анықтауға болмайды (небәрі 20-30 мг) және анализді жүргізу жағдайын (қышқылдылық, температура, тұздардың концентрациясы) қатаң сақтау қажет. Бұл жағдайларды сақтамаған жағдайда анализ оң нәтиже бермейді.
Анықтау әдісін тиімді және ұтымды жүргізу үшін анод пен катод арасында күшті контакт (байланыс) болуы шарт, контакттың бұзылуы цементация құбылысының жүруіне алып келеді.
Сынап катодын пайдаланып электролиз әдісімен металдарды бөлу
Электролиз кезінде сынап катодын пайдалану алюминийді, титанды, цирконийді, магнийді, кальцийді, стронцийді, барийді, бериллийді, ванадийді, фосфат ионын, мышьякты және уранды темірден, хромнан, мырыштан, никельден, кобальттан, мыстан, қалайыдан, висмут пен күмістен оңай бөліп алуға мүмкіндік береді. Аталған металдардың барлығы сынап катодында күкірт қышқылды ерітіндіде тұнбаға түседі. Тұндыруды сондай-ақ НСІ ерітіндісінде де жүргізуге болады, бірақ бұл кезде электролитке гидроксиламин қосылады. Анод ретінде әдетте платина сымын қолданады. Электролизді 5-6 А ток күшінде және 6-7 В кернеуде жүргізеді. Тамшылық сынама әдісі бойынша анықталынатын элементке анализ жасап, электролиздің аяқталғанын біледі. Сонан кейін токты ажыратпай тұрып, электролитті бөліп алады, сынапты сумен жуады. Шайынды суларды электролитке қосып, араластырады, осыдан кейін қажетті компонентті анықтайды.
Сынап катоды платина катодымен салыстырғанда мынадай жетістіктер мен ерекшеліктерге ие:
1. Металдардың басым көбі сынапта жақсы еріп, амальгамма немесе коллоидты ерітінділер түзеді. Осыған байланысты металдардың электролиттік бөлінуі біршама жеңілдейді. Қатты катодта бөлінбейтін көптеген металдар (20 шақты металдар, соның ішінде темір, хром, молибден және т.б.) сынап катодында жеңіл бөлінеді, бірақ алюминий, ванадий, уран, титан тәрізді көптеген басқа металдар бөлінбейді..
2. Сутегі иондарының сынап бетінде разрядталуы, платина бетіндегімен салыстырғанда едәуір жоғары кернеу қажет етеді. Мысалы, платина электродтарында сутегі қышқыл ерітінділерінде 1,7 В кезінде бөлінсе, ал сынап катодында бұл кернеу 2,5 В-ке дейін және одан да жоғарылауы мүмкін. Осыған байланысты сынап катодында электртерістілігі жоғары металдар (мырыш, кадмий, висмут және т.б.) жеңіл бөлінеді. Бұл тұндырулар сутектің бөлінуінсіз жүреді және қатты электродтарды пайдаланған жағдайда ұлпа тәрізді борпылдақ тұнбалар түзіліп, бұл металдардың бөлінуін қиындатады.
Сонымен, сынап катодындағы электролиз металдардың үлкен мөлшерде бөлінуіне мүмкіндік береді және күрделі обьектілер – минералдардың, рудалардың, концентраттардың, құймалардың анализін қарапайым етіп, айтарлықтай жеңілдетеді.
Электрогравиметриялық анализдің қолданылуы
Электроанализ әдісін ең алдымен кейбір металдарды (мыс, никель, мырыш, кадмий, қорғасын және т.б.) өте дәл анықтау үшін қолданады. Кейбір металдар, мысалы сілтілік, сумен жеңіл әрекеттесіп, тотығады. Келесілері электроанализдің кәдімгі жағдайында баяу немесе мардымсыз мөлшерде тұнады (мысалы, висмут, хром, темір). Сондықтан электролиттік тұндыруды анықтауларда қолдану шектеулі.
Бірқатар элементтерді бір-бірінен бөлуде сынап катодындағы электролиттік тұнудың маңызы ерекше және тұну процесі амальгамма түзілетіндіктен жеңіл жүреді. Мысалы, темір құймасындағы алюминий қоспасын анықтау үшін темір және басқа да металдарды сынап катодын пайдаланып, күкірт қышқылды ерітіндіден тұндырады. Бұл кезде алюминий ерітіндіде қалады.
Электрогравиметриялық анализ әдісі металдарды анодтық ерітуде де қолданылады. Мысалы, болат құрамындағы және түрлі түсті құймалар құрамындағы металл емес компоненттерді анықтауды былайша жүргізеді: металл үлгісін сәйкес электролитке батырып, токқа қосады және мұнда анықталынатын зат анод қызметін атқарады. Электролиз кезінде металл ерітіндіге өтеді, ал металл емес қоспалар тұнба түрінде қалады. Бұл әдіс металдардың фазалық анализінде үлкен маңызға ие. Мұнан басқа, металдардың аз мөлшерін анықтауда “іштей” электролиз әдісі қолданылады.
Мыс пен мырышты бөлу және оларды анықтау
Жұмыстың теориялық мәні. Анықтау жұмысы азот қышқылды ерітіндіден мысты катодта мына реакция бойынша тұндырып,
Cu2+ + 2e- = Cu
түзілген тұнбаның салмағын өлшеуге негізделген. Мыс иондарын толығымен бөліп алғаннан кейін, зерттелінетін ерітіндіні сулы-ацетонды (1:2) ортада стандартты NaOH ерітіндісімен потенциометриялық титрлеу әдісі арқылы титрлеп, ерітіндіде қалған мырыш иондарын анықтайды. Осы кезде титрлеу қисығында екі потенциалдар секірісі пайда болады, оның біріншісі – ерітінді құрамындағы күшті қышқылдың кері титрленуіне сәйкес келсе, екіншісі – мырыштың титрленуіне сәйкес келеді.
Жұмыстың орындалуы:
Мысты анықтау. Алдын ала катод және анод пластинкаларының бетін тазалап алу үшін, оларды тартпа шкаф астында HNO3 (1:1) ерітіндісіне батырып, соңынан мұқият дистилденген сумен шаяды. Катодты этил спиртімен шайып, кептіргіш шкафта 1100 С шамасында кептіреді, онан әрі эксикаторда салқындатып, аналитикалық таразыда салмағын өлшейді.
Ток көздерінің полюстеріне сәйкес - анод пен катодты электр сымдарына бекітеді. Электролизерге анализденетін ерітіндіні құйып, үстіне 1 мл 2 М HNO3 ерітіндісінен қосады. Осыдан кейін оған электродтарды батырады және зерттелінетін ерітіндіні дистилденген сумен катодтың біраз бөлігі (5-7 мм) ерітінді бетіне шығып тұратындай мөлшерде сұйылтады. Бұл жағдай келешекте мыстың толығымен тұнбаға түскенін тексеру үшін қажет. Электродтар бір-біріне, сондай-ақ ыдыстың түбі мен қабырғасына да жанаспауы керек. Магниттік араластырғышты қосып, оның ерітіндіні біркелкі араластыруын реттейді. Тізбекті ток көзіне жалғап, электролиз процесін 30-45 минут жүргізеді. Электролиз кезінде прибор арқылы кернеу 2-2,5 В немесе ток күші 1-0,5 А шамасында беріледі. Мыстың тұну дәрежесіне қарай катод қызыл түске боялады, ал ерітінді біртіндеп түссізденеді. Осыдан кейін мыстың толық тұнбаға түскенін тексеру мақсатында электролизерге 10-15 мл-дей дистилденген су қосады. Егер 10 минут ішінде ерітіндіге қайта батырылған катод бетінде мыстың онан әрі бөлінуі байқалмаса, электролизді тоқтадады. Керісінше жағдайда, электролизді тағы да 10-15 минутқа жалғастырады.
Электролиз аяқталғаннан кейін, токты өшірмей тұрып, электродтарды ерітіндіден шығарып, зерттелінетін ерітінді құйылған ыдыстың үстінде ұстап тұрып, дистилденген сумен шаяды. Электродтарды ток қатысында жуу – бөлінген мысты химиялық еруден сақтайды. Осыдан кейін токты өшіріп, катодты этил спиртімен шайып, 1100 С температурада кептіргіш шкафта кептіреді, артынан эксикаторда салқындатып, аналитикалық таразыда өлшейді.
Зерттілінетін ерітіндідегі мыстың мөлшерін тұнбасы бар катод массасы мен таза катод салмағы арасындағы айырмашылықтан анықтайды.
Потенциометриялық титрлеу әдісі арқылы мырышты анықтау.
Cu2+ иондарын электролиз арқылы бөліп алғаннан кейін, ерітіндіні электролизерден өлшеуіш колбаға (сиымдылығы 250 мл) өткізіп, белгіге дейін дистилденген сумен толтырады, араластырады. Осылайша дайындалған ерітіндіден аликвоттық бөлік алып, титрлеуге арналған колбаға құяды. Үстіне 20 мл ацетон қосып, ерітіндіге индикаторлық электрод пен салыстыру электродын батырып, магниттік араластырғыш пен потенциометрді қосады. Титрлеуді 0,1 М NaOH ерітіндісімен жүргізеді. Титрант аздаған порциямен (0,1 мл) құйылып отырады және потенциометрдегі көрсетулер потенциал шкаласы (мВ) бойынша жазылады. Тиртлеу 3 рет жүргізіледі.
Потенциометриялық титрлеу қисығын интегралды және дифференциалды түрде тұрғызады. Ол үшін азот қышқылын титрлеудің соңғы нүктесі (V1) мен HNO3 + Zn2+ (V2) қосындысын табады. Титрант көлеміндегі айырмашылық (V2-V1) зерттелінетін ерітіндідегі мырыш иондарының мөлшеріне сәйкес келеді. Мырыш иондарының мөлшерін мынадай формуламен анықтайды:
MZn2+ = CNaOH(V2-V1) AZn2+ fэквZn2+ Vk / 1000 Vп
Бақылау сұрақтары:
- Электрогравиметриялық анализ әдісінің мәнісі неде?
- Электрогравиметриялық анализ әдісінің негізіне қандай заң кіреді?
3. Электрогравиметриялық анализ әдісіндегі қондырғының негізгі буындарын
атаңыздар.
Падаланған әдебиеттер:
86. Алексеев В.Н. Количественный анализ М.: Химия, 1974
87. Воскресенский А.Г., Семиколенов Г.Ф., Солодкин И.С. Сборник задач и упражнении по аналитической химии. М.: Высшая школа, 1985.
88. Дорохова Е.Н., Прохова Г. В. Аналитическая химия. Физико –химические методы анализа. М.: Высшая школа, 1991
89. Захарова Э.А. Обработка результатов химического анализа. Томск.: Изв-во Томск. Уни-та, 1984
90. Крешков А.П. Основы аналитической химии. М.: Химия, 1971, т. 1,2.
91. Логинов Н. Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. М.: Химия, 1979.
92. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989.
93. Пономарев В.Д. Аналитическая химия 2ч. М.: Высшая школа, 1982
94. Фритц Дж., Шенк Г. Количественный анализ М.: Высшая школа, 1978
95. Чарыков А.К. Математическая обработка результатов химического анализа. Методы обноружения и оценок ошибок. Л.: Химия, 1984
96. Ярославцев А.А. Сборник задач и упражнений по аналитической химии. М.: Высшая школа, 1979
Қышқылдардың, сілтілердің және тұздардың қалыпты
жағдайдағы диссоциациялану дәрежесі
| Электролиттің аталуы және оның формуласы | Диссоциациялану дәрежесі, % | |
| 1 н. ерітінділерде | 0,1 н. ерітінділерде | |
| Қышқылдар Азот қышқылы НNO3 Тұз қышқылы НСІ Бромсутек қышқылы НBr Иодсутек қышқылы НJ Күкірт қышқылы H2SO4 Қымыздық қышқылы Н2С2О4 Фосфор қышқылы Н3РО4 Күкіртті қышқыл H2SO3 Фторсутек қышқылы HF Шарап қышқылы Н2С4Н4О6 Сірке қышқылы СН3СООН Көмір қышқылы Н2СО3 Күкіртсутек қышқылы Н2S Бор қышқылы Н3ВО3 Циан қышқылы НСN | - - - - - - - 0,4 - - - - | 1,3 0,17 0,07 0,01 0,007 |
| Негіздер Калий гидроксиді КОН Натрий гидроксиді NаОН Аммоний гидроксиді NН4ОН | 0,4 | 1,3 |
| Тұздар МеА типтегі (КСl, NaNO3, т.б.) Ме2А және МеА2 типтегі (К2SO4, К2СО3, ВаСl2, Са(NO3)2) Ме3А немесе МеА3 типтегі (К3РО4, К3[Fe(CN)6], AlCl3, Cr(NO3)3) Ме2А2 типтегі (СuSO4, ZnSO4) | - - - - |
Күшті электролиттер үшін диссоциациялану дәрежесі “шартты” түрде берілген. Екі және көп негізді қышқылдар үшін диссоциацияланудың бірінші сатысының мәндері берілген.
7-кесте. Кейбір әлсіз электролиттердің диссоциациялану
константасы (250С кезіндегі)
| Электролит және оның формуласы | Диссоциация константасы | 250 С кезіндегі диссоциация константасының мәні |
| Су Бейорганикалық қышқылдар Азотты қышқыл НNО2 Алюминийлі қышқыл НАlО2 Кремний қышқылы H2SіO3 a - Қалайы қышқылы H2SnO3 b - Қалайы қышқылы H2SnO2 Күкірт қышқылы H2SO4 (диссоциацияның 2-ші сатысы) Күкіртті қышқыл H2SO3 Күкіртсутек қышқылы H2S | 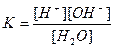
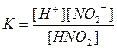
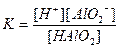
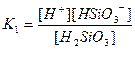
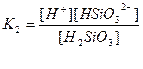
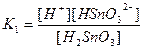
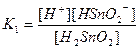
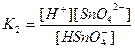
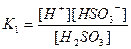
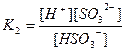
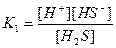
| 1,8 , 10-16 4,0 , 10-4 4,0 , 10-13 1,0 , 10-10 2,0 , 10-12 4,0 , 10-10 6,0 , 10-18 1,2 , 10-2 1,7 , 10-2 6,0 , 10-2 5,7 , 10-8 |
Ж а л ғ а с ы
| Электролит және оның формуласы | Диссоциация константасы | 250 С кезіндегі диссоциация константасының мәні |
| Циансутек қышқылы HCN Көмір қышқылы H2CO3 Фосфор қышқылы H3PO 4 Хром қышқылы H CrO2 Органикалық қышқылдар Шарап қышқылы H2C4H4O6 | 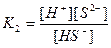
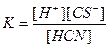
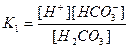
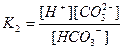
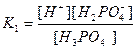
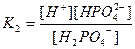
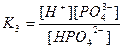
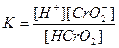
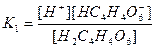
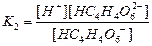
| 1,2 , 10-15 7,2 , 10-10 4,3 , 10-7 5,6 , 10-11 7,5 , 10-3 6,2 , 10-8 2,2 , 10-13 9,0 , 10-17 1,0 , 10-3 4,6 , 10-5 |
Ж а л ғ а с ы
| Электролит және оның формуласы | Диссоциация константасы | 250 С кезіндегі диссоциация константасының мәні |
| Құмырсқа қышқылы HCOOH Сірке қышқылы CH3COOH Қымыздық қышқылы H2C2O4 Негіздер Аммоний гидроксиді NH4OH Кальций гидроксиді Ca(OH)2 | 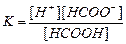
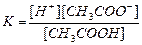
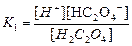
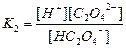
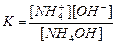
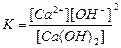
| 1,8 , 10-4 1,8 , 10-5 5,9 , 10-2 6,4 , 10-5 1,8 , 10-5 3,0 , 10-2 |
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 755; Нарушение авторских прав?; Мы поможем в написании вашей работы!