
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хронокондуктометрия 20 страница
|
|
|
|
Әдістің мынадай бірқатар кемшіліктері бар:
1. Тұрақты ток күшінде жүргізілетін кулонометриялық титрлеуде, электродтағы электрохимиялық реакция жүретін потенциалды қатаң бақылап отыру барлық уақытта мүмкін бола бермейді. Потенциалдың ығысуы нәтижесінде, параллель жүретін қосымша электродтық процестердің жүруіне мүмкіндік туады. Бұл зерттелінетін реакцияның ток бойынша шығымы мен кулонометриялық анықтаулардың дәлдігін төмендетеді;
2. Кулонометриялық титрлеу әдісінің дәлдігі мен сезімталдығы тек эквиваленттік нүктені дәл анықтаумен ғана шектеледі.
Кулонометриялық титрлеу әдісі көптеген заттардың, қосылыстардың мөлшерін анықтауда кеңінен қолданылады. Көптеген еңбектер нейтралдану реакцияларына негізделген кулонометриялық титрлеу әдістеріне арналған. Бұл жағдайда Н+ және ОН- иондары генерацияланатын титрлеуші реагент болып табылады. Соңғы кезде сусыз ортада титрлеу мүмкіндіктерін зерттеуге арналған жұмыстар қарастырылуда.
22.1-кестеде кулонометриялық титрлеу әдісінде жиі қолданылатын электргенерацияланатын титранттар мен олардың көмегімен анықталынатын заттардың тізімі келтіріліген.
Пайдаланған әдебиеттер:
53. Алексеев В.Н. Количественный анализ М.: Химия, 1974
54. Воскресенский А.Г., Семиколенов Г.Ф., Солодкин И.С. Сборник задач и упражнении по аналитической химии. М.: Высшая школа, 1985.
55. Дорохова Е.Н., Прохова Г. В. Аналитическая химия. Физико –химические методы анализа. М.: Высшая школа, 1991
56. Захарова Э.А. Обработка результатов химического анализа. Томск.: Изв-во Томск. Уни-та, 1984
57. Крешков А.П. Основы аналитической химии. М.: Химия, 1971, т. 1,2.
58. Логинов Н. Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. М.: Химия, 1979.
59. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989.
60. Пономарев В.Д. Аналитическая химия 2ч. М.: Высшая школа, 1982
61. Фритц Дж., Шенк Г. Количественный анализ М.: Высшая школа, 1978
62. Чарыков А.К. Математическая обработка результатов химического анализа. Методы обноружения и оценок ошибок. Л.: Химия, 1984
63. Ярославцев А.А. Сборник задач и упражнений по аналитической химии. М.: Высшая школа, 1979
№ 12 Лекцияның тақырыбы: Тотығу-тотықсыздану әдісі бойынша кулонометриялық титрлеу
Сабақтың жоспары:
- Тотығу-тотықсыздану әдісі бойынша кулонометриялық титрлеу
- Қышқылды-негіздік әдіс бойынша жүргізілетін кулонометриялық титрлеу әдісі
Сабақтың мақсаты: Тотығу - тотықсыздану титрлеу әдісімен студенттерді таныстыру, титрлеу қисығын тұрғызып, эквивалент нүктесін анықтау.
Электрактивті емес заттарды (оксиндер, аминдер, фенолдар және т.б.) платина анодында бромидтен электрогенерацияланған Br2 арқылы электрохимиялық реакцияға сәйкес анықтауға болады:
2Br- - 2e ® Br2
3Br2 + C6H5OH «C6H2Br3OH + 3Br- + 3H+
Қарастырылып отырған жағдайда, фенол электр активті емес болғандықтан, бір ғана электродтық реакция – бромидтің тотығуы жүреді, ал фенол электродта түзілген броммен әрекеттесе отырып химиялық титрленеді. Бромның артық мөлшерін оңай анықтауға болады. Электрогенерацияланған Br2 молекуласын кері титрлеу әдістерінде, сондай-ақ органикалық қосылыстардың өте баяу жүретін бромдау реакциясы кезінде де қолдануға болады. Электргенерацияланған бромның Br2 артық мөлшері қандай да бір электргенерацияланған тотықсыздандырғышпен (екі валентті мыс тұзынан ® Сu+) титрленеді.
Егер анықталынатын зат электрактивті болса, мысалы Се4+ иондарын анықтау үшін ерітіндіге жеткілікті мөлшерде Ғе3+ ерітіндісін қосады. іэ>іd кезінде (21.3-сурет) платина катодында екі электрохимиялық реакция жүреді:
Се4+ + е ® Се3+
Ғе3+ + е ® Ғе2+
Бұған қосымша Ғе2+ және Се4+ арасында химиялық реакция жүреді:
Се4+ + Ғе2+ «Се4+ + Ғе3+
 |  |
Тізбектен өткен барлық электр мөлшері, Се4+ ионын тотықсыздандыруға жұмсалады, ал көмекші реагенттің мөлшері соңғы нүктеге дейін катодта тотықсызданған Ғе2+ иондарымен Се4+ иондарының химиялық тотығу реакциясының салдарынан регенацияланып, тұрақты болып қалады. Соңғы нүктеден кейін пайда болған артық мөлшердегі Ғе2+ иондары Ғе3+/Ғе2+ жұбының тотығу-тотықсыздану потенциалын күрт төмендетеді, оны потенциометриялық әдіспен оңай анықтауға болады (22.3-сурет).
Кулонометриялық титрлеуде электрогенерацияланатын тотықтырғыштар ретінде - Ag (ІІ), Mn (VІІ), Fe (ІІІ), Cr (VІ), V (VІ), Mo (V), Br2, Cl2, J2, [Fe(CN)6]3- және т.б. кеңінен қолданылады. Ал, электргенерацияланатын тотықсыздандырғыштарға - Сu (І), U (ІV және V), Tі (ІІ), Sn (ІІ), V (ІV), Cr (ІІ), Fe (ІІ) иондары жатады.
Қышқылды-негіздік әдіс бойынша жүргізілетін кулонометриялық титрлеу әдісі
Платина катодында іэ>іd кезінде екі электрохимиялық реакция жүзеге асады:
2Н+ + 2е ® Н2¯
2Н2О + 2е ® Н2¯ + 2ОН-
Қосымша жүретін химиялық реакция:
ОН- + Н+ «Н2О
Катодта электрогенерацияланған ОН- иондарының күшті қышқыл ерітіндісімен титрлеудің түрлі сатыларындағы титрлеу қисығы і=f(E) 22.4–суретте берілген. Соңғы реакция аяқталғаннан кейін пайда болған артық мөлшердегі ОН- иондарын ерітінді рН-ын анықтауға арналған кез келген әдістердің (мәселен, қышқылды-негіздік индикатордың немесе рН-метрдің) көмегімен анықтауға болады.
 |
22.4-сурет. Қышқылды-негіздік әдіс бойынша кулонометриялық титрлеу. Электр генерацияланған ОН- иондары арқылы күшті қышқылды анықтау кезіндегі і=f(E) қисығының өзгерісі
Ерітіндідегі аз мөлшерлі тұз қышқылын анықтау
Қышқылды-негізді кулонометриялық титрлеу әдісінің бір жетістігі – арнайы көмекші реагентті қажет етпейді, өйткені оның қызметін еріткіш – су молекуласы атқарады. Тұз қышқылының мөлшерін анықтау әдісі сутегі иондарының катодта тікелей Н2 түзе электрохимиялық тотықсыздануына және олардың электролиз кезінде Н2О молекуласынан электрогенерацияланған ОН- иондарымен нейтралдануының параллель жүруіне негізделген.
Электролиз кезіндегі ток мөлшеріне және ерітіндідегі қышқыл концентрациясына тәуелді жұмысшы (генераторлық) электродында мынадай процестердің жүзеге асуы мүмкін:
2Н3О+ + 2е ® Н2 + 2Н2О
Бұл І < Іd (анықталынатын қышқыл құрамындағы сутегі иондарының шекті тогы) жағдайында, ал І > Іd жағдайында бірмезгілде
2Н3О+ + 2е ® Н2 + 2Н2О
2Н2О + 2е ® Н2 + 2ОН-
Әдетте, қышқылдың үлкен мөлшерін анықтағанда, кулонометриялық титрлеудің бастапқы сәтінде І < Іd жағдайы орын алады, сондықтан алғашқы реакция бойынша сутегі бөлінеді. Ерітіндідегі сутегі иондарының концентрациясы азайғанда ғана (яғни Іd < І болғанда) ОН- иондарының электрогенерациясы жүреді, бұл өз кезегінде мынадай химиялық реакция арқылы өтеді:
Н3О+ + ОН- «2Н2О
Соңғы реакция аяқталғаннан кейін ОН- иондарының артық мөлшері ерітіндіні сілтілендіреді, мұны сәйкес қышқылды-негіздік индикаторлар түсінің өзгеруінен немесе рН-метр көмегімен оңай анықтауға болады.
Ерітіндіде кездесуі мүмкін қышқылдық сипаттағы қоспалардан арылу үшін (әсіресе еріген СО2-ден) фонды ерітіндіні аладын ала электролиздейді. Бұл кезде жүзеге асатын электрохимиялық реакцияны мынадай теңдеу бойынша бейнелеуге болады:
2Н2СО3 + 2е ® Н2 + 2НСО3-
Ерітіндіде бикарбонат иондарының түзілуін ескере отырып, индикатор ретінде фенолфталеинді қолдануға немесе алдын ала электролиз жүргізгендегідей, тұз қышқылының кулонометриялық титрлеу процесінін рН-метр көмегімен нақты бір рН мәніне (мысалы, рН 8) жеткенше жүргізуге болады. Ерітіндінің электр өткізгіштігін жоғарылату үшін фон ретінде инертті күшті электролит (мысалы, K2SO4) пайдаланылады.
Жұмыстың орындалу барысы
1. Кулонометриялық қондырғы жинайды, генерациялық және индикациялық тізбектер құрастырады. Генерациялық тізбектің қосқышы бұл кезде іске қосылмаған жағдайда болады.
2. Жұмысшы катод камерасы бар ұяшық дайындайды. Электродтарды дистилденген сумен шаяды. Сиымдылығы 250 мл болатын, мұқият жуылған шыны стақанға (жұмысшы камерасының қызметін атқаратын) 10 %-тік K2SO4 ерітіндісінен 25 мл және 50 мл дистилденген су құяды. Барлық электродтар стақандағы ерітіндіге, сондай-ақ шыны электродтың ұшы да, байланыстырушы тұз көпіршесінің де ұшы фонды ерітіндіге батып тұруы керек. Тұз көпіршесінің келесі ұшы 10 %-тік K2SO4 ерітіндісімен толтырылған және арнаулы ұстағышқа бекітіліп анодтық камераға батырылады.
3. Зерттелінетін ерітіндіні 100 мл-лік өлшеуіш колбада дистилденген сумен сұйылтады, жақсылап араластырады. Штативке бекітілген бюретканы дайындалған ерітіндімен толтырады.
Тұрақты ток көзінен реттей отырып, қажетті ток мәнін (2-7 мА аралығында) алады, бұл генерациялық тізбектегі миллиамперметрде тіркеледі.
Ерітінді барлық уақыт араластырылып отырады, тіпті кулонометриялық титрлеу кезінде де тоқтатылмайды.
Фонды ерітіндінің рН-ын өлшеп, жұмысшы дәптерге оның рН мәнін жазып алады.
Осыдан кейін фонды ерітіндінің алдын ала электролизін жүргізеді. Ерітіндінің рН-ы 6-ға жеткеннен кейін рН-метрді 6-10 өлшеулер интервалында ұстайды. Алдын ала жүргізілген электролиз процесін ерітінді рН-ы белгілі мәнге жеткенше жүргізеді. рН мәнінің тұрақты мәнге келуін күтеді (рН <8).
Фонды ерітіндісі бар стақанға (алдын ала электролиз жүргізілетін) зерттелінетін ерітіндінің аликвоттық бөлігін (мысалы, 5 мл) бюреткадан қосады. Стақанға барлық электродтарды батырады. Ерітіндіні тұрақты рН мәніне жеткенше араластырады. Осы мәнді дәптерге жазып алады.
Кулонометриялық титрлеуге бастау үшін электролиттік ұяшық тізбегін қайта тұйықтайды және осымен бірмезгілде секундомерді іске қосады. Миллиамперметр арқылы генерацияланған ток мөлшерінің нақты мәнін жазып алады. Титрлеу соңында рН-метрді “6-10” өлшеулер шегіне алмастырады. Титрлеуді алдын ала электролиздеудегі сияқты, ерітінді рН-ы 8-ге жеткенде аяқталды деп есептейді. Осы мезетпен бірмезгілде генерациялық ток пен секундомерді ажыратады. Титрлеуді дәл осылайша әр түрлі көлемде бірнеше рет қайталайды. Әрбір титрлеу кезінде зерттелінетін ерітіндінің жаңа порциясы (2-5 мл аралығында) ретімен алынып, сол бастапқы фонды ерітіндіге құйылады, яғни бүкіл жұмыс барысында фонды ерітінді ауыстырылмайды.
Электр мөлшерін (Q=Іt) есептейді және осыдан зерттелінетін ерітінді құрамындағы тұз қышқылының мөлшерін мг бойынша анықтайды. Анализ нәтижелеріне статистикалық өңдеулер жүргізіп, нәтижелерін төмендегі кестеге енгізеді:
| Зерттеліне-тін НСІ көлемі, мл | Бастапқы рН мәні | І, мА | t, сек | mQ | Анықталған НСІ мөлшері, мг бойынша |
Натрий тиосульфатын анықтау
Жұмыстың теориялық мәні
Натрий тиосульфатын кулонометриялық титрлеу әдісі бойынша анықтау жұмысын иод арқылы жүргізеді. Иод анодта калий иодидінен электрогенерацияланады. Процестің соңғы нүктесі крахмал көмегімен анықталынады.
Жұмыстың орындалуыі
1. Кулонометрлік титрлеуге арналған қондырғы мен генерациялық тізбек жинайды.
2. Титрлеуге арналған ұяшыққа 20 мл 1 М КІ ерітіндісін, 20 мл дистилденген су, 1 мл 1%-тік крахмал ерітіндісін және зерттелінетін ерітіндінің аликвоттық бөлігін (3-7 мл) құяды. Ерітіндіге анод қызметін атқарушы генераторлық электроды (платина) мен байланыстырушы көпіршенің бір ұшын батырады. Ал оның екінші ұшын көмекші электроды орналастырылған катод камерасына батырады.
3. Кулонометриялық қондырғының генерацияланған ток мөлшері 4-6 мА болуы керек. Осыдан кейін генерациялық тізбек пен секундомерді бірмезгілде қосады да, бағдарлауға арналған титрлеу процесін көк түсті ерітінді пайда болғанша жүргізеді. Титрлеуді кем дегенде 5 рет жүргізеді. Бұл кезде фонды ерітінді ауыстырылмайды және ерітіндінің сол бір интенсивті түсі бақыланады.
4. Жұмыс дәптеріне кулонометриялық титрлеудің нәтижелері (І, мА, t және с) жазылып, зерттелінетін ерітіндідегі Na2S2O3 мөлшері мг бойынша есептелінеді. Титрлеу нәтижелері статистикалық әдіспен өңделеді.
Кесте 22.1. Кулонометриялық титрлеуде жиі қолданылатын электргенерация-ланатын титранттар мен олардың көмегімен анықталынатын заттар
| Электрогенерацияланатын титрант | Анықталынатын зат |
| Cl2 Br2 | Гидразин, Тl (І), Fe (ІІ), Fe (ІІІ), фенолдар,Tl (І), As (ІІІ), Zn (ІІ), Fe(ІІ), Fe(ІІІ), Гидразин, дикетондар, аскарбин қышқылы, ароматты аминдер, аминофенол, анилин |
| І2 | Sb(ІІІ), As(ІІІ), S2O32-, гидразин, фенолдар, аскарбин қышқылы, гидрохинон |
| Mn(ІІІ) | Fe(ІІІ), Nb(ІІ), Sb(ІІ), қымыздық қышқылы |
| Се (ІV) | H2O2 және U(ІV), гидроксиламин |
| Ті (ІІІ) | V(V), Fe (ІІІ), Cr(VІ), U(V), n-хинондиоксим |
| Sn (ІІ) | Ce(ІV), K2Cr2O7, І2, Br2 |
| Fe (ІІ) | Ce(ІV), U(VІ), Cr(VІ), Te(ІV), Cl2(VІ), U(VІ), Pu(ІІ), Mn(VІ) |
| Fe(CN)63- | Tl (І) |
| Fe(CN)64- | Cu (ІІ), Zn (ІІ) |
| Cr (ІІ) | Cu (ІІ) |
| Ag (І) | Cl-, Br-, J-, CNS-, меркаптандар, тиомочевина |
| U (V) | Fe (ІІ), V (V) |
| ЭДТА | Са(ІІ), Ва(ІІ), Sr(ІІ), Cu(ІІ), Cd(ІІ), Pb(ІІ), Zn(ІІ), Nі(ІІ), Co(ІІ), Ce(ІІІ), Ce(ІV), Mn(ІІ), V(ІІІ), Nb(ІІІ) |
Бақылау сұрақтары:
6. Кулонометрия. Кулонометрлік қондырғылар.
7. Кулонометриялық титрлеу әдісінің негізі.
8. Кулонометрлік титрлеу қисығы. Эквиваленттік нүктені анықтау.
Пайдаланған әдебиеттер:
64. Алексеев В.Н. Количественный анализ М.: Химия, 1974
65. Воскресенский А.Г., Семиколенов Г.Ф., Солодкин И.С. Сборник задач и упражнении по аналитической химии. М.: Высшая школа, 1985.
66. Дорохова Е.Н., Прохова Г. В. Аналитическая химия. Физико –химические методы анализа. М.: Высшая школа, 1991
67. Захарова Э.А. Обработка результатов химического анализа. Томск.: Изв-во Томск. Уни-та, 1984
68. Крешков А.П. Основы аналитической химии. М.: Химия, 1971, т. 1,2.
69. Логинов Н. Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. М.: Химия, 1979.
70. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989.
71. Пономарев В.Д. Аналитическая химия 2ч. М.: Высшая школа, 1982
72. Фритц Дж., Шенк Г. Количественный анализ М.: Высшая школа, 1978
73. Чарыков А.К. Математическая обработка результатов химического анализа. Методы обноружения и оценок ошибок. Л.: Химия, 1984
74. Ярославцев А.А. Сборник задач и упражнений по аналитической химии. М.: Высшая школа, 1979
№13-14 Лекция тақырыбы: Электрогравиметриялық анализ әдісінің теориялық негіздері
Сабақтың жоспары:
1. Әдістің теориялық негізі
2. Анализ әдісінің түрлері
Сабақтың мақсаты: Электрогравиметриялық анализ әдісінің теориялық негіздерін оқыту.
Электрогравиметриялық анализ әдісі анықталынатын затты ерітіндіден тұнбаға электролиз арқылы түсіріп, соңынан оның салмағы бойынша сынамадағы анықталынатын элементтің сандық мөлшерін анықтауға негізделген. Әдетте бұл әдісті теріс электродта (катодта) элементар күйінде бөлінетін металдарды анықтау үшін қолданады. Анализ кезінде платина тәрізді инертті электродтарды пайдаланған жөн және электролиз көбіне тұрақты ток күшінде жүргізіледі.
Гравиметриялық анализде тұнбаға қойылатын бірінші талап – олардың іс жүзінде ерімеуі – электроанализде жақсы орындалады, өйткені металдардың көбісі суда ерімейді. Дегенмен, электролиттік тұну электролиз процесінің уақыттан бұрын аяқталып қалуына байланысты барлық уақытта соңына дейін жүре бермейді. Электролиз кезінде тұну процесі анықталынатын ион электрод бетіне жақындаған сәтте ғана жүреді, сондықтан ерітіндіні араластырудың маңызы зор.
Тұнбаға қойылатын екінші талап – оның тазалығы, тұнба құрамының белгілі формулаға сәйкес келуі. Бұл талап әдеттегі гравиметриялық анализ әдістеріне қарағанда, электролиттік тұну кезінде өте жақсы орындалады.
Тұнбаға қойылатын үшінші талап – жұмыс істеуге қолайлы болуы үшін тұнбаның белгілі бір агрегаттық формада алынуы, бұл әдетте электролиз кезінде жақсы сақталады. Арнайы физика-химиялық жағдайда тұнба электрод бетінде тығыз қабат түрінде алынады да, тұнбаны сүзу операциясы қажет етілмейді және тұнбаны жуу аз ғана уақытты алады.
Фарадей заңы электролит ерітіндісінен өткен электр мөлшері мен электролиз нәтижесінде электродтарда түзілген өнімдердің салмағы арасындағы қатынасты анықтайды. Анықталынатын элементтің 1 моль ионын тотықсыздандыруға электр мөлшерінің 96 500 Кулонға тең электрохимиялық эквиваленті қажет болатындықтан элементтің белгілі мөлшерін (m) тұндыруға қажетті уақытты (t) анықтауға болады.
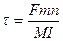
Мұндағы n - тотықсыздандыруға жұмсалған электрон саны;
Ғ - Фарадей тұрақтысы, 96 500 Кл;
М – молекулалық масса;
І - ток күші.
Әдетте, бұл әдіс бойынша платина катодында мыс, мырыш, кадмий, никель, қалайы, күміс, сурьма және тағы басқа металдарды бөліп алуға болады. Платина электродында металдың бөлінуі мынадай реакция бойынша жылдам жүзеге асады:
Меz+ + ze- ® Me
Механикалық шығынды болдырмау үшін тұндырылатын металл тығыз болып, және электродтың металдық фазасымен мықты байланысуы керек. Мұндай талаптарды анодта бөлінетін кейбір заттар да (PbO2, Co2O3) қанағаттандырады.
Тұндырылған металл аналитикалық таразыда өлшенетіндіктен, анализ соңында ерітіндіде қалатын металл иондарының салмағы 3.10-4 грамнан аспауы керек. Мұндай салмаққа иондардың 3.10-4 /ММеz+ V мөлшері ие және олардың концентрациясы мынаған тең:
[Mez+]max= 3.10-4 / ММеz+ v
Мұндағы ММеz+ - бөлінетін иондардың молярлық массасы, г/моль;
v – ерітінді көлемі, л.
Егер v=0,2 л және ММеz+ =50-150 г/моль болса, тотықсызданатын иондардың ең жоғарғы концентрациясы 3.10-4 -1.10-4 моль/л болады және осы кезде электролизді тоқтатуға болады. Сондықтан бағыт-бағдар ретінде электролизді концентрация 10-5 моль/л немесе рМе 5 болғанша жүргізуге болады деп қабылдаған жөн.
Құрамында бірнеше катиондары бар ерітінділердің анализі кезінде потенциал мәніне қатаң бақылау жасалынады. Катиондардың бөліну потенциалдары бір-бірінен өте күшті айырмашылық жасайтын жағдайларда металдардың электродтарда тұндырылуын жекеленген тәсілмен жүргізуге болады. Ерітіндіге металл иондарымен беріктілігі әртүрлі комплекс түзуге қабілетті комплекс түзгіштерді қосу металдардың әр түрлі потенциалда бөлінуіне әкеледі.
Электрогравиметриялық анализ әдісін жүргізу үшін 23.1–суреттегідей қондырғы жинайды. Тұрақты ток көзі ретінде аккумулятор батареялары немесе айнымалы токқа арналған ток түзеткіш 1 (выпрямитель) қолданылады. Жылжымалы контакт (2) берілетін кернеуді реттеп отыруға мүмкіндік береді. Кернеу вольтметр арқылы өлшенеді. Ток күші амперметр көмегімен беріледі. Металдардың бөлінуі кезінде қолданылатын катодты (5) әдетте платина торынан, анодты (4) платина спиралінен немесе пластинасынан жасайды. Оксидтерді тұндырғанда электродтардың таңбасы өзгереді: платина тоы – анод, ал спираль – катод болады. Ерітінді магниттік араластырғыш арқылы араластырылады.
Электрогравиметриялық анализ әдісін гравиметриялық анализдің бір түрі десе де болады, себебі мұнда тұндырғыш ретінде электрондар реакцияға түседі. Осылайша электролиттік жолмен алынған металл және оксид шөгінділері әрі тұндыру формасы, әрі гравиметриялық форма болып табылады.
Тұндыру формасына қойылатын талаптарға тұнбаның ерігішітігінің аз және тазалығы жоғары болуы жатады. Бұл талаптар электрогравиметриялық анализде идеальді орындалады, өйткені көптеген металдар мен оксидтер суда мүлдем ерімейді, ал оларды электролиттік бөліп алу кезінде қосарлана тұну процесі жүрмейді немесе оны электролиз жағдайын таңдау арқылы жоюға болады. Түзілген металды немесе оксидті жуу, таразыда тарту ыңғайлы.
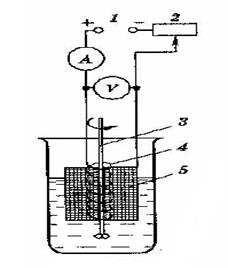
23.1-сурет. Электрогравиметриялық анализді жүргізуге арналған қондырғы
Электрогравиметриялық анализ әдістері
Практикада электрогравиметриялық анализдің екі түрі қолданылады, атап айтқанда: бақыланатын потенциалда жүргізілетін электролиз (немесе потенциостатикалық электролиз режиміндегі электрогравиметрия) және тұрақты ток күшіндегі электролиз (немесе гальваностатикалық электролиз режиміндегі электрогравиметрия).
Потенциостатикалық электролиз режиміндегі электрогравиметрия
Ерітіндіге құрамындағы иондар қоспасын алдын ала бөлмей-ақ сараптама жүргізу үшін электролизді қатаң түрде бақыланатын катод потенциалында жүргізеді. Потенциал мәні белгілі бір деңгейде ұсталуы тиіс. Ол үшін электролиз схемасына потенциалы тұрақты қосымша электрод (мысалы, каломельді электрод) және электронды реттегіш қондырғы енгізеді. Электронды қондырғы – потенциостат - жұмысшы және қосымша электродтарды байланыстырады.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 713; Нарушение авторских прав?; Мы поможем в написании вашей работы!