
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения. Комплексными называются соединения высшего порядка, в узлах кристаллической решетки которых находятся комплексные ионы
|
|
|
|
Комплексными называются соединения высшего порядка, в узлах кристаллической решетки которых находятся комплексные ионы, способные к самостоятельному существованию в растворе.
Комплексные соединения образуются при сочетании электронейтральных, насыщенных молекул (с позиции классического понятия «валентность») простых и сложных веществ. Например:
BF3 + HF = H[BF4];
KNO3 + AgNO3 = K[Ag(NO3)2].
Структура комплексного соединения состоит из внутренней (координационной) и внешней сфер. Более тесно связанные частицы внутренней сферы называют комплексным ионом или комплексом. При написании координационной формулы эту часть комплексного соединения заключают в квадратные скобки.
Внутренняя сфера состоит из центральной частицы – комплексообразователя (иона или атома) и окружающих его лигандов (аддендов). Роль комплексообразователей чаще всего выполняют катионы переходных металлов, реже анионы или нейтральные молекулы. Лигандами могут быть кислотные остатки и ионы гидроксила (Cl–, NO3–, СN–, ОН– и др.), электронейтральные молекулы (Н2О, СО и др.), а также те и другие одновременно. Количество лигандов, располагающихся вокруг комплексообразователя, называется координационным числом (к.ч.).
За пределами внутренней сферы находится внешняя сфера, содержащая положительно заряженные ионы, если комплексный ион заряжен отрицательно и отрицательно заряженные ионы, если комплексный ион заряжен положительно. В случае незаряженной внутренней сферы внешняя сфера отсутствует.
Например, K2[PtCl4]: Pt+2 – комплексообразователь; Cl– - лиганд; [PtCl4]2– – комплексный ион, внутреняя координационная сфера; K+ – внешняя координационная сфера; 4 – координационное число. Координационные числа комплексообразователей (центральных атомов) в растворах могут меняться в зависимости от их заряда:
| Заряд центрального атома | +1 | +2 | +3 | +4 |
| Координационное число |
Для объяснения и расчета химической связи в комплексных соединениях существуют несколько теорий (метод валентных связей, теория кристаллического поля, метод молекулярных орбиталей), которые основаны на положениях квантовой химии.
При растворении ионы внешней сферы легко отщепляются, и комплексное соединение практически нацело диссоциирует на внутреннюю и внешнюю сферы:
K2[PtCL4] ⇄ 2K+ + [PtCl4]2–.
Эта диссоциация называется первичной. Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией:
 ⇄
⇄ 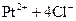 .
.
В результате вторичной диссоциации устанавливается равновесие, которое характеризуется константой равновесия, называемой константой нестойкости комплексного иона:
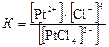 .
.
Чем меньше константа нестойкости, тем более устойчив данный комплексный ион.
Номенклатура комплексных соединений. Названия комплексных соединений составляют по следующим правилам:
1. Первым в именительном падеже называют анион, а потом в родительном – катион.
2. При составлении названия сначала перечисляют в порядке увеличения их сложности: лиганды-анионы, лиганды-молекулы, лиганды-катионы, а затем указывают центральный атом. Если центральный атом входит в состав комплексного катиона, то используют русское название элемента, а в скобках римскими цифрами указывают степень его окисления. Если центральный атом входит в состав комплексного аниона, то употребляют латинское название этого элемента, после него римской цифрой обозначают степень окисления, а в конце прибавляют суффикс «ат». Названия нейтральных комплексных частиц образуют так же, как и катионов, но комплексообразователь называют в именительном падеже, а степень его окисления не указывают, так как она определяется электронейтральностью комплекса.
3. К названиям лигандов-анионов прибавляют окончание «о» (Cl– – хлоро, CN– – циано). Названия нейтральных лигандов окончания «о» не имеют (вода – аква, NH3 – аммин). Число лигандов указывают приставками: ди-, три-, тетра- и т.д., образованными от греческих числительных.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 927; Нарушение авторских прав?; Мы поможем в написании вашей работы!