
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы химической связи
|
|
|
|
Химическая связь и типы взаимодействия молекул
Химическая связь – это взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.
В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую.
Основные характеристики связи.
Энергия связи (Е, кДж/моль) – количество энергии, выделяющееся при образовании химической связи. Чем больше энергия связи, тем устойчивее молекулы.
Длина связи – расстояние между ядрами химически связанных атомов.
Кратность связи – определяется количеством электронных пар, связывающих два атома. С увеличением кратности связи длина связи уменьшается, а прочность ее возрастает.
Валентный угол – угол между воображаемыми линиями, которые можно провести через ядра связанных атомов. Валентный угол определяет геометрию молекул.
Дипольный момент возникает, если связь образована между атомами элементов с разной электроотрицательностью и служит мерой полярности молекулы.
Ковалентная связь образуется путем обобществления пары электронов двумя атомами. Особенностями ковалентной химической связи являются ее направленность и насыщаемость. Направленность обусловлена тем, что атомные орбитали имеют определенную конфигурацию и расположение в пространстве. Перекрывание орбиталей при образовании связи осуществляется по соответствующим направлениям. Насыщаемость обусловлена ограниченными валентными возможностями атомов.
Различают ковалентную полярную и неполярную связь. Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью; обобществленные электроны равномерно распределены между ядрами взаимодействующих атомов. Ковалентная полярная связь образуется между атомами с различной электроотрицательностью; общие электронные пары смещены в сторону более электроотрицательного элемента.
Описание связей в молекуле основано на определении распределения электронной плотности вблизи ядра. Это трудная, а зачастую и неразрешимая задача. Поэтому на практике используют упрощенные методы – метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
Метод ВС рассматривает химическую связь как результат притяжения ядер двух атомов к одной или нескольким общим для них электронным парам.
Возможны два механизма образования ковалентной связи: 1) спаривание электронов двух атомов при условии противоположной ориентации их спинов (обменный механизм); 2) донорно-акцепторное взаимодействие, при котором общей становится электронная пара одного из атомов (донора) при наличии энергетически выгодной свободной орбитали другого атома (акцептора).
Часто в образовании связи участвуют электроны разных подуровней, а, следовательно, орбитали разных конфигураций. В этом случае может происходить гибридизация (смешение) электронных облаков (орбиталей). Образуются новые, гибридные облака с одинаковой формой и энергией. Число гибридных орбиталей равно числу исходных. В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, приводящее к повышению энергии связи. Гибридизация АО определяет пространственную конфигурацию молекул.
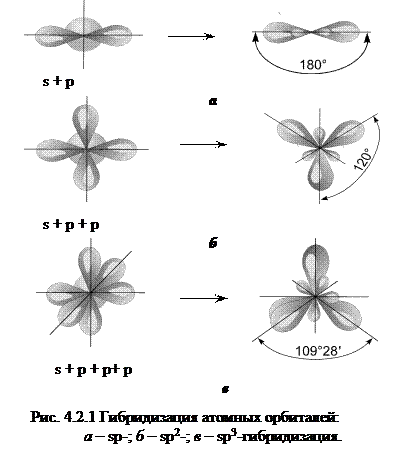

Так, при смешении одной s -орбитали и одной p -орбитали, образуются две гибридные орбитали, угол между которыми 180о, такой тип гибридизации называется sp -гибридизацией (рис. 4.2.1, а). Молекулы, в которых осуществляется sp -гибридизация, имеют линейную геометрию (C2H2, BeF2).
При смешении одной s и двух p -орбиталей образуются 3 гибридные орбитали, угол между которыми 120о. Такой тип гибридизации называется sp 2-гибридизацией, ему соответствует образование плоской треугольной молекулы (BF3, C2H4) (рис. 4.2.1, б).
При смешении одной s и трех p -орбиталей образуются четыре sp 3-гибридные орбитали, угол между которыми 109о28'. Форма такой молекулы является тетраэдрической (рис. 4.2.1, в). Примеры таких молекул: CCl4, CH4, GeCl4.
При определении типа гибридизации необходимо также учитывать неподеленные электронные пары элемента. Например, кислород в молекуле воды (Н2О) имеет sp3-гибридизацию (4 гибридных орбитали), а химическая связь с атомами водорода образована двумя электронными парами.
Возможны также более сложные виды гибридизации с участием d и f- орбиталей атомов.
Ионная связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Ее можно рассматривать как предельный случай ковалентной полярной связи. Такая связь возникает лишь в случае большой разности электроотрицательностей взаимодействующих атомов, например между катионами s -металлов I и II групп периодической системы и анионами неметаллов VI и VII групп (LiF, CsCl, KBr и др.).
Так как электростатическое поле иона имеет сферическую симметрию, то ионная связь не обладает направленностью. Ей также не свойственна насыщаемость. Все ионные соединения в твердом состоянии образуют ионные кристаллические решетки, в узлах которых каждый ион окружен несколькими ионами противоположного знака. Чисто ионной связи не существует. Можно говорить лишь о доле ионности связи.
Металлическая связь. В отличие от ковалентных и ионных соединений в металлах небольшое число электронов одновременно связывает большое число ядерных центров, а сами электроны могут перемещаться в металле. Таким образом, в металлах имеет место сильно нелокализованная химическая связь.Подробнее металлическая связь рассмотрена во второй части учебного пособия.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 2565; Нарушение авторских прав?; Мы поможем в написании вашей работы!