
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантово-механическая модель атома. Строение многоэлектронных атомов
|
|
|
|
Химия и периодическая система элементов
ОСНОВЫ СТРОЕНИЯ ВЕЩЕСТВА
В основе современного учения о строении атома лежат представления квантовой механики о двойственной корпускулярно-волновой природе микрочастиц. Основным уравнением квантовой механики является волновое уравнение Шредингера (1926), решениями которого являются так называемые волновые функции y (пси), характеризующие состояние электрона в атоме. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества его орбитального движения (в силовом поле ядра) и проекции этого момента на выделенное в пространстве направление. Околоядерное пространство, в котором с наибольшей вероятностью (0,9–0,95) может находиться электрон, называется атомной орбиталью (АО). Занимая ту или иную АО, электрон образует электронное облако.
Атомная орбиталь характеризуется тремя параметрами, получившими название квантовых чисел (l, ml, n). Четвертое квантовое число, которое называют спиновым (ms), характеризует собственный момент движения электрона. Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения.
Главное квантовое число n характеризует энергию электрона в атоме; оно принимает положительные целочисленные значения: n = 1, 2, 3…∞; определяет энергетический уровень и размеры электронного облака.
Орбитальное квантовое число l определяет форму электронного облака, энергетический подуровень. Орбитальные квантовые числа для электронов с данным главным квантовым числом могут принимать значения: l = 0, 1, 2…(n -1). Энергетические подуровни обозначаются: s (l = 0), p (l = 1), d (l = 2), f (l = 3). Значению l = 0 соответствует форма электронного облака в виде сферы (рис. 4.1.1, а); значению l = 1 соответствует электронное облако в виде «гантели» (рис.4.1.1, б), значению l = 2 – в более сложном виде (рис. 4.1.1, в).


а б

в
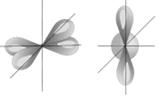
Рис. 4.1.1. Форма и пространственное расположение орбиталей: а – s -; б – p -; в – d орбитали.
Магнитное квантовое число ml характеризует пространственную ориентацию электронного облака. Магнитное квантовое число принимает значения ml = –l,…0…, l. Число значений ml зависит от l (всего (2 l +1) значений) и определяет количество орбиталей на данном подуровне. Таким образом, на s -подуровне (l = 0) имеется одна орбиталь, на p -подуровне (l = 1) – три орбитали, на d- подуровне (l = 2) – пять орбиталей.
Значения главного, орбитального и магнитного квантовых чисел в четырех первых периодах периодической таблицы Д. И. Менделеева приведены в табл. 4.1.1
Таблица 4.1.1.
Значения n, l, ml и максимального числа электронов в периодах
| n | Название орбитали | l | m l = – l …0… l | Число орбиталей | Максимальное число электронов | |
| на подуровне | на уровне | |||||
| s | ||||||
| s | ||||||
| p | –1, 0, 1 | |||||
| s | ||||||
| p | –1, 0, 1 | |||||
| d | –2, –1, 0, 1, 2 | |||||
| s | ||||||
| p | –1, 0, 1 | |||||
| d | –2, –1, 0, 1, 2 | |||||
| f | –3, –2, –1, 0, 1, 2, 3 |
Спиновое квантовое число ms принимает только два значения: –1/2 и +1/2. ms характеризует внутреннее движение электрона – спин, оно связано с собственным магнитным моментом электрона, обусловленным его движением вокруг своей оси. Два электрона с противоположно направленными спинами ↑↓ называют спаренными или антипараллельными, с одинаково направленными ↑↑ – неспаренными или параллельными.
Распределение электронов в атомах элементов по АО определяется тремя положениями: принципом Паули, правилами Клечковского и Хунда.
Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Так как АО характеризуется тремя квантовыми числами n, l и ml, то на одной орбитали могут находиться не более двух электронов, причем с противоположными спинами ↑↓.
Так как количество орбиталей на данном подуровне равно числу значений ml, т. е. (2 l +1), то максимальное число электронов на этом подуровне согласно принципу Паули будет 2(2 l +1). Таким образом, на s -подуровне возможно 2 электрона (2(2 ∙ 0 + 1) = 2), на p -подуровне – 6 электронов, на d -подуровне – 10 электронов, на f -подуровне – 14 электронов. Поскольку число орбиталей данного энергетического уровня равно n 2, емкость энергетического уровня составляет 2 n 2 электронов.
Правило Клечковского: увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равной сумме – в порядке возрастания главного квантового числа n. Согласно этому правилу заполнение электронами энергетических уровней и подуровней идет в такой последовательности:
1 s→ 2 s→ 2 p→ 3 s→ 3 p→ 4 s→ 3 d→ 4 p→ 5 s→ 4 d→ 5 p→ 6 s→ 4 f→
→ 5 d→ 6 p→ 7 s…
Исключения из правила Клечковского наблюдаются для атомов элементов с полностью или наполовину заполненными подуровнями
– d -элементы: Cr 4s13d5, Cu 3d104s1, Nb 5s14d4, Mo 5s14d5, Ru 5s14d7, Rh 5s14d8, Pd 5s04d10, Ag 5s14d10, Pt 6s15d9, Au 6s15d10;
– все f -элементы.
Правило Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Следовательно, орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами.
Распределение электронов в атоме записывается в виде электронных формул nlx, где n – главное квантовое число (указывается цифрой), l – орбитальное квантовое число (буквенное обозначение), x – число электронов на данном подуровне. Последовательность заполнения электронами орбиталей различных электронных слоев можно представить следующим образом:
1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 2…
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 735; Нарушение авторских прав?; Мы поможем в написании вашей работы!