
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи для самостоятельного решения. Записываем уравнение реакции горения углерода: C + O2 ⇄ CO2↑ (1)
|
|
|
|
Решение
Записываем уравнение реакции горения углерода:
| C + O2 ⇄ CO2↑ | (1) |
Рассчитаем количество вещества углерода:
n (C) = 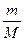 =
= 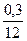 = 0,025 моль.
= 0,025 моль.
Согласно уравнению реакции:
n (CO2)= n (C); n (CO2) = 0,025 моль.
Определим массу Ba(OH)2 в растворе:
m (Ba(OH)2) =  =
= 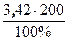 = 6,84 г.
= 6,84 г.
Рассчитаем количество вещества Ba(OH)2:
n (Ba(OH)2) =  =
= 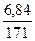 = 0,04 моль.
= 0,04 моль.
Ba(OH)2 будет реагировать с CO2 по уравнению:
| Ba(OH)2 + CO2 → BaCO3 ↓ + H2O. | (2) |
В соответствии с уравнением реакции 0,025 моль CO2 реагирует с 0,04 моль Ba(OH)2. Значит, гидроксид бария находится в избытке; поэтому расчёт массы осадка BaCO3проводим по CO2. Согласно (2):
n (BaCO3) = n (CO2); n (BaCO3) = 0,025 моль.
Определим массу осадка:
m (BaCO3) = n (BaCO3) · M (BaCO3) = 0,025 · 197 = 4,93 г.
41. Классифицируйте химические соединения: Н3AsO4, AgBr, Mg(OH)2, HI, Hg2O2, Al(OH)3, MnO2, Cr2O3, KOH, H2SiO3, Fe(HCO3)2, (CuOH)2SO4, Na3PO4 и дайте им названия.
42. Назовите ионы: S2-, NO3-, NO2-, IO3-, MnO4-, HPO42-,. Напишите формулы и названия кислот, из которых они образуются.
43. Назовите соли: К2СrO4, KMnO4, Na2SO3, NaClO, CaOHNO2, Cа(HS)2 и приведите формулы и названия соответствующих им кислот.
44. Напишите формулы оксидов, которым соответствуют следующие основания и кислоты: Mn(OH)2, Bi(OH)3, Cu(OH)2, LiOH, H3PO4, H2SiO3, HNO3, HNO2. Назовите вещества.
45. Классифицируйте следующие основания по кислотности: RbOH, Fe(OH)2, Mn(OH)2, Ca(OH)2, Ti(OH)2. Назовите их. Напишите формулы соответствующих им оксидов.
46. Напишите формулы и названия кислот, соответствующих оксидам: SO2, SO3, P2O3, P2O5, CO2, N2O5, Cl2O, SiO2, Cl2O7.
47. Классифицируйте и назовите следующие соли: MgSO4, (СиОН)2SО4, KH2SbO4, Ba(HS)2, NiOHNO3, CrPO4, Mn(NO3)2.
48. На 5,2 г смеси Zn и ZnO подействовали NaOH. Выделившийся газ подожгли, и он образовал 0,36 г Н2О. Определить содержание цинка (%) в исходной смеси.
Ответ: 25%
49. К раствору, содержащему 100 г серной кислоты, добавили 100 г NаОН. Какая (кислая или средняя) соль и в каком количестве образуется?
Ответ: 1,25 моль
50. При действии раствора NaOH на 26 г смеси алюминия и меди выделилось 2,8 л газа (н.у.). Найдите процентное содержание меди в смеси.
Ответ: 87%
51. Какой объем сернистого газа (н.у.) может быть поглощен 800 мл 10% раствора NaOH (ρ = 1,11 г/мл)?
Ответ: 24,86 л
52. Сколько аммиачной селитры NH4NО3 должно получиться при нейтрализации 15 г 20% раствора азотной кислоты раствором аммиака?
Ответ: 1,72 г
53. Какой минимальный объем СО2 (н.у.) необходимо пропустить через 5% раствор Ва(ОН)2 массой 80 г для получения гидрокарбоната бария?
Ответ: 1,05 л
54. Напишите уравнения реакций, доказывающих: амфотерный характер SnO2; основный характер Ca(OH)2; кислотный характер H3PO4.
55. Какие из перечисленных гидроксидов реагируют как с кислотами, так и со щелочами: Be(OH)2, Fe(OH)3, Mg(OH)2, Mn(OH)2, Mn(OH)4, Cu(OH)2? Приведите уравнения реакций.
56. Составьте уравнения реакций получения перечисленных солей всеми возможными способами: а) гидроксохлорида кальция; б) гидрокарбоната меди; в) ортофосфата калия.
57. Какие уравнения реакций между кислотами и основаниями приводят к образованию солей: NiS, NaHSiO3, AlOH(NO3)2?
58. Запишите уравнения реакций, соответствующих образованию из приведённых ниже кислот и оснований всех возможных кислых, средних, основных солей: Ba(OH)2, H2CO3, NaOH, HI.
59. С какими из следующих веществ будет реагировать сернистая кислота: K, H2O, NaOH, Cu, BaO, CaCO3, Mg(OH)2? Напишите уравнения реакций в молекулярной и ионной формах.
60. С какими из следующих веществ будет реагировать гидроксид натрия: CO2, H2SiO3, P2O5, BeO, CuO, H3PO4, Al(OH)3, Pb(OH)2. Напишите соответствующие уравнения реакций.
Контрольные вопросы
1. Дайте понятие степени окисления.
2. Что такое оксиды? Как их классифицируют по химическим свойствам?
3. Что такое гидроксиды? Классификация гидроксидов.
4. Что такое основность кислоты, кислотность основания?
5. Дайте определение соли. Классификация солей.
6. Какие кислоты образуют кислые соли? Какие основания образуют основные соли?
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1394; Нарушение авторских прав?; Мы поможем в написании вашей работы!