
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 1
|
|
|
|
Укажите продукты реакции и на основании электронных уравнений расставьте коэффициенты в уравнении:
1. Ca + HNO3 (разб)→…; 3. Ca + NaOH → …;
2. Sn + HNO3 (разб)→…; 4. Sn + NaOH (р-р) → …
Решение. Кальций и олово не пассивируются в разбавленной азотной кислоте, поэтому продукты реакции взаимодействия металлов с кислотами указываем, пользуясь таблицей 4.2.1. Кальций активный металл, поэтому помимо соли и воды образуется третий продукт – N2O:
1. Ca + HNO3 (разб)→ Сa(NO3)2 + H2O + N2O.Олово металл средней активности, поэтому помимо соли и воды образуется третий продукт – NO:2. Sn + HNO3 (разб) → Sn(NO3)2 + H2O + NO.Составим электронный баланс:| 1. Ca – 2 e – → Ca+2 | 4 |
| N+5+ 4 e –→ N+ | 2 |
| 2. Sn – 2 e – → Sn+2 | 3 |
| N+5+ 3 e – → N+2 | 2 |
| Sn –2 e – → Sn+2 | 1 |
| H++ 1 e –→ H0 | 2 |
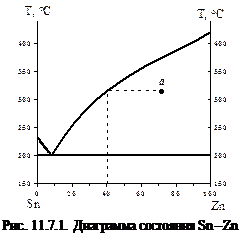 Пример 2. Охарактеризуйте состояние сплава и определите состав каждой фазы в точке Sn: Zn = 30 %: 70 % при температуре 320 ºС. Руководствуясь видом диаграммы состояния вещества, определите, к какому типу сплавов оно относится.
Пример 2. Охарактеризуйте состояние сплава и определите состав каждой фазы в точке Sn: Zn = 30 %: 70 % при температуре 320 ºС. Руководствуясь видом диаграммы состояния вещества, определите, к какому типу сплавов оно относится.
Решение. Это диаграмма веществ, образующих механическую смесь. Отметим на диаграмме точку, в которой необходимо описать состав фаз (точка а). Проведем линию до пересечения с линиями диаграммы и опустим абсциссу для нахождения состава жидкой фазы. В точке а присутствуют две фазы: жидкая и твердая. Твердая фаза представляет собой кристаллы цинка; состав жидкой фазы – Zn:Sn = 40:60.
10.8. Задачи для самостоятельного решения401–420. Укажите продукты реакции и на основании электронных уравнений расставьте коэффициенты в уравнении:
| 401. | Pb + HNO3 (разб) →…; | Cr + HNO3 (конц)→… |
| 402. | Pb + HNO3 (конц)→…; | Pb + KOH →… |
| 403. | Sn + HNO3 (разб) →…; | Ag + H2SO4 (разб) →… |
| 404. | Pb + KOH + H2O →…; | Pb + H2SO4 (конц)→… |
| 405. | Sn + KOH + H2O →…; | Bi + H2O →… |
| 406. | Zn + H2SO4 (конц)→…; | Ag + H2SO4 (конц)→… |
| 407. | Hg + HNO3 (конц)→…; | Co + Ca(NO3)2 →… |
| 408. | Ca + CuSO4 →…; | Co + HNO3 (конц)→… |
| 409. | Mg + Al2(SO4)3 →…; | Au + HCl →… |
| 410. | Cu + Mg(NO3)2 →…; | Zn + CuCl2 →… |
| 411. | Mg + Cu(NO3)2 →…; | Co + CaCl2 →… |
| 412. | Pb + AgNO3 →…; | Bi + HCl →… |
| 413. | Ag + HNO3 (конц)→…; | Be + HNO3 (конц)→… |
| 414. | Zn + HNO3 (разб)→…; | Hg + H2SO4 (разб)→… |
| 415. | Zn + HNO3 (конц)→…; | Zn + KOH+H2O →… |
| 416. | Co + H2SO4 (конц)→…; | Mg + HCl →… |
| 417. | Bi + H2SO4 (конц)→…; | Bi + HCl → … |
| 418. | Be + KOH + H2O →…; | Fe + H2SO4 (конц)→… |
| 419. | Mg + H2SO4 (конц)→…; | Al + KOH+H2O →… |
| 420. | Mg + H2SO4 (разб)→…; | Fe + HNO3 (разб)→… |
433. Предложите способ выделения магния из морской воды, если предположить, что весь магний находится в ней в виде хлорида. Составьте уравнения соответствующих реакций.
436. Укажите, к диэлектрикам, проводникам или полупроводникам относятся приведенные ниже вещества:
| Вещество | S | P | Au | B | Fe |
| Ширина запрещенной зоны (Δ Е), эВ | 9,7 | 1,5 | – | 1,55 | – |
| Вещество | InSb | AlP | C | Si | Pb |
| Ширина запрещенной зоны (Δ Е), эВ | 0,27 | 5,6 | 1,12 | – |
| Вещество | TiBi | CuBr | Ag | β-Sn | Ge |
| Ширина запрещенной зоны (Δ Е), эВ | – | 2,94 | – | – | 0,78 |


Контрольные вопросы
1. Чем объясняются такие свойства металлов, как электропроводность и пластичность?
2. Почему хром, железо и бериллий не растворяются в концентрированной азотной кислоте?
3. Чем объясняется тот факт, что медь, серебро и висмут не растворяются в соляной кислоте?
4. Укажите необходимое условие взаимодействия металлов с растворами щелочей.
5. Влияет ли активность металлов на состав продуктов, образующийся при их взаимодействии с концентрированной серной кислотой?
6. Какой тип диаграмм образуют металлы, не растворимые друг в друге?
7. Какой тип диаграмм образуют металлы, неограниченно растворимые друг в друге?
8. Какой тип диаграмм образуют металлы, образующие химическое соединение?
9. Какой вывод можно сделать о свойствах материала, зная величину ширины запрещенной зоны?
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1776; Нарушение авторских прав?; Мы поможем в написании вашей работы!