
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественный анализ. Некоторые реагенты для идентификации катионов Реагент Формула Катион Аналитический сигнал Гексагидроксостибиат калия
|
|
|
|
Некоторые реагенты для идентификации катионов
| Реагент | Формула | Катион | Аналитический сигнал |
| Гексагидроксостибиат калия | K[Sb(OH)6] | Na+ | Белый осадок |
| Реактив Несслера | K2[HgJ4] + KOH | NН4+ | Кирпично-красный осадок |
| Хромат калия | К2СrО4 | Ag+ | Кирпично-красный осадок |
| Иодид калия | KJ | Pb2+ | Жёлтый осадок |
| Дихромат калия | К2Сr2О7 | Са2+ | Оранжевый осадок |
| Ализарин | С14Н6О2(ОН)2 | Аl3+ | Ярко-красный осадок |
| Гексацианоферрат (II) калия | K4[Fe(CN)6] | Fe3+ | Тёмно-синий осадок |
| Сu2+ | Красно-бурый осадок | ||
| Роданид калия | КСNS | Fe3+ | Кроваво-красный осадок |
| Гексацианоферрат (III) калия | K3[Fe(CN)6] | Fe2+ | Тёмно-синий осадок |
Большое значение имеют условия проведения аналитических реакций. При изменении условий (pH раствора, введение маскирующего агента, температура и т. д.) групповые реакции могут стать избирательными, а избирательные – специфичными или наоборот. Так, S2–– групповой реагент, но после введения в раствор CN– большинство ионов металлов связываются в прочные комплексы и S2–осаждает только Cd2+ и Zn2+. CN–– маскирующий агент, реакция стала избирательной.
В отличие от катионов почти все анионы можно открыть дробным методом в отдельной порции исследуемого раствора в присутствии других анионов. Поэтому последовательность обнаружения отдельных анионов не имеет принципиального значения, хотя целесообразно все же сначала обнаружить менее стойкие анионы, а также те анионы, которые в большей мере мешают обнаружению других ионов.
Задачей количественного анализа является определение количественного содержания компонентов в объекте.
При количественном анализе измеряют различные химические, физические и физико-химические параметры анализируемого образца, которые зависят от его состава или содержания того или иного компонента.
В соответствии с этим все методы количественного анализа можно разделить на химические и инструментальные (физические и физико-химические).
Химические методы анализа включают гравиметрические (весовые) и титриметрические (объемные) методы.
Гравиметрические методы основаны на измерении массы определяемого компонента пробы, отделенного от остальных компонентов системы в виде соединения с точно известным составом.
Обычно выделение компонента проводят путем осаждения, иногда – в виде летучего соединения (методы отгонки).
Сущность методов осаждения заключается в том, что определяемый компонент раствора вступает в химическую реакцию с прибавляемым реагентом-осадителем, образуя малорастворимый продукт – осадок, который отделяют, промывают, высушивают и взвешивают на аналитических весах.
Сущность методов отгонки заключается в том, что определяемый компонент выделяют из анализируемой пробы в виде газообразного вещества и измеряют либо массу отогнанного вещества (прямой метод), либо массу остатка (косвенный метод).
Менее трудоёмким является электрогравиметрический метод, при котором определяемый металл, например, серебро, осаждают на катоде (платиновой сетке):
Ag+ + 1 e – ® Ag0.
По разности массы катода до и после электролиза определяют массу металла в анализируемом растворе. Однако этот метод можно использовать только для анализа металлов, на которых не выделяется водород (медь, серебро, ртуть).
Титриметричесике методы заключаются в точном измерении объемов растворов реагирующих веществ. В титриметрическом анализе измеряют объемы двух взаимодействующих растворов и по известной концентрации одного из них определяют неизвестную концентрацию другого.
Вещества реагируют между собой в эквивалентных количествах (n 1 = n 2). Так как
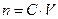 , ,
| (14.2.1) |
где С – молярная концентрация эквивалента, а V – объем, в котором растворено вещество, то для двух стехиометрически реагирующих веществ справедливо соотношение
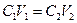 . .
| (14.2.2) |
Следовательно, можно найти неизвестную концентрацию одного из веществ (например, С 2), если известны объем его раствора и объем и концентрация прореагировавшего с ним вещества.
Зная молекулярную массу эквивалента M, находят массу вещества:
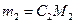 . .
| (14.2.3) |
Чтобы зафиксировать конец реакции, который называют точкой стехиометричности, или точкой эквивалентности (т. э.), раствор с известной концентрацией вещества (его называют титрантом) постепенно, небольшими порциями добавляют к раствору определяемого вещества. Этот процесс называют титрованием.
Экспериментально конец титрования устанавливают по изменению цвета индикатора или какого-либо физико-химического свойства раствора. Эта точка называется конечной точкой титрования (к. т. т.) и в общем случае не совпадает с теоретически рассчитанной точкой эквивалентности.
Индикатор – это вещество, которое в области т. э. изменяет свой цвет, образует осадок или вызывает какой-то другой аналитический сигнал.
По классификации, основанной на природе аналитической реакции, лежащей в её основе, различают: кислотно-основное титрование (связано с переносом протона); осадительное титрование (связано с образованием малорастворимых соединений); комплексонометрическое титрование (связано с образованием координационных соединений); окислительно-восстановительное титрование (связано с переносом электронов).
В основе кислотно-основного титрования лежит реакция нейтрализации
Н++ ОН–⇄ Н2О,
поэтому метод кислотно-основного титрования также называют методом нейтрализации.
Например, данный метод позволяет определить концентрацию кислоты титрованием раствором щелочи и наоборот. В процессе титрования изменяется рН раствора, поэтому т. э. (точка эквивалентности) устанавливается при помощи кислотно-основных индикаторов, изменяющих окраску в определённом интервале рН; к. т. т. (конечную точку титрования) получают с помощью рН-метра.
Зависимость изменения рН титруемого раствора от объёма прибавленного титранта представляют в виде кривых титрования.
Кривая титрования – это зависимость измеряемого параметра системы (рН, концентрации, потенциала) от объема титранта.
Метод кислотно-основного титрования наряду с комплексонометрическим применяют для определения такого технологического параметра воды, как жёсткость.
Определение жесткости воды
Жесткость воды характеризуют молярной концентрацией эквивалентов кальция и магния и выражают в ммоль/дм3. Суммарное содержание в водном растворе солей кальция и магния составляет общую жёсткость, которая делится на карбонатную, или устранимую, жесткость и постоянную. Карбонатная жесткость определяется содержанием в воде гидрокарбонатов, при кипячении они разлагаются:
Са(НСО3)2 = СаСО3↓ + Н2О + СО2,
Mg(НСО3)2 = Mg(ОН)2↓ + 2СО2,
и жесткость воды уменьшается. Поэтому карбонатную жесткость называют устранимой.
Постоянная жесткость вызывается наличием в воде сульфатов и хлоридов кальция и магния и при кипячении не уменьшается.
Карбонатную жесткость воды можно определить методом кислотно-основного титрования хлороводородной кислотой в присутствии индикатора метилового оранжевого:
НСО 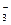 + Н+ ⇄ Н2О + СО2.
+ Н+ ⇄ Н2О + СО2.
В точке эквивалентности желтая окраска индикатора переходит в бледно-розовую. Расчет производится по уравнению (4.4.2.2):
С н НСО3– · V 1 = С н НСl · V 2,
где V 1 и V 2 – объёмы анализируемого и титрованного растворов; С н НСl – молярная концентрация эквивалентов вещества НСl в титрованном растворе, С н НСО 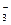 – определяемая молярная концентрация эквивалентов ионов НСО
– определяемая молярная концентрация эквивалентов ионов НСО 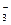 в анализируемом растворе.
в анализируемом растворе.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 954; Нарушение авторских прав?; Мы поможем в написании вашей работы!