
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия Гиббса и ее изменение в ходе химических реакций
|
|
|
|
С точки зрения термодинамики в химических процессах появляются две тенденции:
· стремление к образованию связей между частицами, к возникновению более сложных агрегатов, сопровождающееся понижением энергии системы, снижением энтальпии;
· стремление к беспорядочному расположению частиц, их разъединению, характеризуемое увеличением энтропии.
Каждая их этих противоположных тенденций, количественно выражаемая значениями Δ H и Δ S, зависит от природы веществ и условий протекания процесса (температура, давление, соотношение между реагентами и др.).
В условиях постоянных давления и температуры, функцией, сопоставляющей эти тенденции, является энергия Гиббса или изобарно-изотермический потенциал, измеряется в кДж/моль:
 .
.
· Стандартное изменение энергии Гиббса химической реакции равно разности между суммами изменения энергии Гиббса образования продуктов и исходных веществ с учетом стехиометрических коэффициентов:
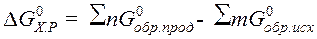
D G 0 простых веществ равно нулю.
Изменение энергии Гиббса характеризует возможность и направление самопроизвольного протекания процессов:
·  > 0 – реакция может самопроизвольно протекать в обратном направлении;
> 0 – реакция может самопроизвольно протекать в обратном направлении;
·  < 0 – реакция может самопроизвольно протекать в прямом направлении;
< 0 – реакция может самопроизвольно протекать в прямом направлении;
·  = 0 – система находится в состоянии равновесия.
= 0 – система находится в состоянии равновесия.
Если пренебречь зависимостями D Н и D S от температуры и считать их постоянными, можно рассчитать 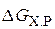 при нестандартной температуре. Исходя из этого можно рассчитать температуру, при которой устанавливается состояние равновесия:
при нестандартной температуре. Исходя из этого можно рассчитать температуру, при которой устанавливается состояние равновесия:
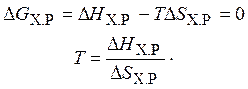
Если в ходе расчетов значение температуры установления состояния равновесия имеет отрицательное значение (по шкале Кельвина), можно сделать вывод, что состояние равновесия в системе недостижимо, реакция во всем температурном интервале может самопроизвольно протекать либо в прямом, либо в обратном направлении.
Проанализируем зависимость 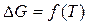 . Если пренебречь зависимостями величин DH и DS от температуры, то
. Если пренебречь зависимостями величин DH и DS от температуры, то 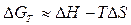 является уравнением прямой. Возможны четыре варианта расположения прямой по отношению к осям координат в зависимости от знаков DH и DS (рис. 1).
является уравнением прямой. Возможны четыре варианта расположения прямой по отношению к осям координат в зависимости от знаков DH и DS (рис. 1).

Рис. 1. График зависимости 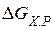 от температуры
от температуры
1. DH < 0, DS < 0. Прямые реакции термодинамически возможны (DGХ.Р < 0) при температурах до Т /, при температурах свыше Т / (DGХ.Р > 0) возможны обратные реакции.
2. DH > 0, DS > 0. Прямые реакции термодинамически возможны (DGХ.Р < 0) при температурах свыше Т /, при температурах до Т / возможны обратные реакции.
3. DH > 0, DS < 0. Во всем диапазоне температур значение DGХ.Р > 0, т.е. прямые реакции термодинамически невозможны при любых температурах.
4. DH < 0, DS > 0. Во всем диапазоне температур значение DGХ.Р < 0, т.е. прямые реакции термодинамически возможны при любых температурах.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2244; Нарушение авторских прав?; Мы поможем в написании вашей работы!