
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения заданий. Пример 1. Укажите степень окисления (СО) подчеркнутых атомов элементов в предложенных частицах, а также их высшую и низшую степени окисления
|
|
|
|
Пример 1. Укажите степень окисления (СО) подчеркнутых атомов элементов в предложенных частицах, а также их высшую и низшую степени окисления. Объясните, какую роль могут выполнять указанные частицы в окислительно-восстановительных реакциях: только окислитель (Ox), только восстановитель (Red), окислитель и восстановитель (Ox и Red).
Cr 2O3, Сl O4–, Zn, H2 S
Cr 2O3 2х + 3·(- 2) = 0 CO = +3
Хром – элемент VI группы, следовательно, высшая степень окисления его +6, т. к. хром является металлом, то его низшая степень окисления 0. В данном случае хром проявляет промежуточную степень окисления, следовательно, в окислительно-восстановительных реакциях данная частица может быть и окислителем и восстановителем (Ox и Red).
Сl O4– х + 4·(- 2) = –1 CO = +7
Хлор – элемент VII группы, следовательно, высшая степень окисления его +7, хлор – неметалл, следовательно низшая степень окисления его 7 - 8 = -1. В окислительно-восстановительных реакциях Сl O4– может быть только окислителем (Ox).
Zn CO = 0
Цинк – элемент II группы, следовательно, высшая степень окисления его +2, цинк – металл, низшая степень окисления 0. В окислительно-восстановительных реакциях Zn может быть только восстановителем (Red).
H2 S 2·(- 1) + х = 0 CO = -2
Сера – элемент VI группы, значит, его высшая степень окисления +6, низшая степень окисления серы 6 – 8 = -2, следовательно, в окислительно-восстановительных реакциях H2S может быть только восстановителем (Red).
 Ox и Red
Ox и Red
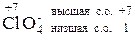 Ox
Ox
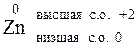 Red
Red
 Red
Red
Пример 2. Составьте уравнение полуреакций в заданной среде:
Cr2O72– ® Cr3+ (кислая);
Cr2O3 ® CrO42– (щелочная);
Br2 ® BrO– (нейтральная);
MnO4– ® MnO2 (нейтральная).
Алгоритм составления уравнения полуреакции.
1. Рассчитывают степени окисления атомов элементов, которые ее изменяют.
2. Уравнивают их количество (при необходимости).
3. В соответствии с правилами среды уравнивают количество атомов кислорода и водорода.
4. Указывают количество отданных или принятых электронов.
Cr2O72– ® Cr3+
1. Степень окисления изменяет хром: с +6 в Cr2O72– до +3 в Cr3+;
2. Уравнивают количество атомов хрома:
Cr2O72– ® 2 Cr3+
3. В правую часть для восполнения недостатка 7 атомов кислорода запишем 7 Н2О; в левую часть для уравнивания водорода запишем 14 Н+:
Cr2O72– + 14 Н+ ® 2 Cr3+ + 7 Н2О
4. Степень окисления изменяет хром с +6 до +3, принимая 3ē, учитывая что в полуреакции участвует 2 атома хрома, принимается 6ē:
Cr2O72– + 14 Н+ + 6ē ® 2 Cr3+ + 7 Н2О
Cr2O3 ® CrO42–
1. Степень окисления изменяет хром: с +3 в Cr2O3 до +6 в CrO42–;
2. Уравнивают количество атомов хрома:
Cr2O3 ® 2 CrO42–
3. В левой части недостаток 5 атомов кислорода, добавим 10 ОН –;
в правую часть для уравнивания водорода и кислорода запишем 5 Н2О:
Cr2O3 + 10 ОН –® 2 CrO42– + 5 Н2О
4. Степень окисления изменяет хром с +3 до +6, отдавая 3ē, учитывая, что в полуреакции участвует 2 атома хрома, отдается 6ē:
Cr2O3 + 10 ОН – – 6ē ® 2 CrO42– + 5 Н2О
Br2 ® BrO–
1. Степень окисления изменяет бром: с 0 в Br2 до +1 в BrO–;
2. Уравнивают количество атомов брома:
Br2 ® 2 BrO–;
3. Разница по кислороду в обеих частях (с учетом коэффициента) составляет 2 атома, следовательно, в левую часть необходимо записать 2 Н2О, при этом кислород в обеих частях уравнивается, следовательно, необходимо уравнять в правой части водород, добавив 4Н+:
Br2 + 2 Н2О ® 2 BrO– + 4Н+;
4. Степень окисления изменяет бром с 0 до +1, отдавая 1ē, учитывая, что в полуреакции участвует 2 атома брома, отдается 2ē:
Br2 + 2 Н2О – 2ē ® 2 BrO– + 4Н+;
MnO4– ® MnO2
1. Степень окисления изменяет марганец: с +7 в MnO4– до +4 в MnO2;
2. Количество атомов марганца в обеих частях одинаково, коэффициенты не требуются.
3. Разница по кислороду в обеих частях составляет 2 атома, следовательно, в левую часть необходимо записать 2 Н2О, при этом кислород в обеих частях не уравнялся, следовательно, необходимо уравнять его, добавив в правой части 4 ОН–:
MnO4– + 2 Н2О ® MnO2 + 4 ОН–;
4. Степень окисления изменяет марганец с +7 до +4, принимая 3ē:
MnO4– + 2 Н2О + 3ē ® MnO2 + 4 ОН–;
Пример 2. Запишите электронно-ионные уравнения полуреакций, ионное и молекулярное уравнения реакции, соответствующее данному превращению:
+5 +4 0 +6
КIO3 + Na2SO3 + Н2SO4 ® I2, SO42–
Ox Red среда
К+ + IO3– + 2 Na+ +SO32– + 2 Н+ + SO42– ® I2, SO42–

 2 IO3– + 12Н + + 10ē ® I2 + 6Н2О 2 1
2 IO3– + 12Н + + 10ē ® I2 + 6Н2О 2 1
 SO32– + Н2О - 2ē ® SO42– + 2Н + 10 5
SO32– + Н2О - 2ē ® SO42– + 2Н + 10 5
2 IO3– + 12Н + + 5SO32– + 5Н2О ® I2 + 6Н2О + 5SO42– + 10Н +
2 IO3– + 2Н + + 5SO32– ® I2 + Н2О + 5SO42–
2K+ SO42– 10Na+ 10Na+ 2K+ SO42-
2КIO3 + 5Na2SO3 + Н2SO4 ® I2 + H2O + 5Na2SO4 + K2SO4.
6.5. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ
1. Рассчитайте и укажите степень окисления (СО) атомов подчеркнутых элементов в предложенных частицах. Объясните, какую роль могут выполнять предложенные частицы в окислительно-восстановительных реакциях: только окислитель (Ox), только восстановитель (Red), окислитель и восстановитель (Ox и Red).
| Cr O33–, Mn O2, Pb O2, Cr 2O72– | P 2O3, C O, Al O2–, N O3– | ||
| Сd, Al O2–, N 2O, N O3– | Zn, H2 S O3, H N O3, Cl O4– | ||
| Al 2O3, Mn O4–, Br –, Cr O42– | V O3–, N O2, Mn 2+, Al | ||
| C O2, Mn O2, Mn O42–, Cl - | H2 S, Cl 2, S O42–, Cr 2O72– | ||
| N O3–, N O, Cr 2O72–, S O32- | S O32–, N O2–, Cl O4–, Br – | ||
| Br O–, Br –, Cd 2+, Cr O42– | Cr O2–, Re O4–, Pb O2, Cr O42– | ||
| N 2, Cl –, Cr O2–, B 4O72– | N O2–, Mn O2, N O2, Cu | ||
| Ti O2+, Cl O–, Cl O–, Mn O4– | S O42–, Cl2, Mn 2+, Cl O– | ||
| Mn O42–, N O3–, N H4+, Cl O3– | Cl O4–, Cl –, Cr O2–, F 2 | ||
| N H4OH, V O2+, Cl 2, V O3– | Ca, N O3–, Br O–, N O2– | ||
| N O2, H 3PO4, H Cl, Cr O42– | S O42–, C O, H2 S, Mn O42– | ||
| N O3–, Cl O3–, Mn, S 2– | C O2, Cr 2O72–, Br O–, Se O42– | ||
| Sn 2+, C H4, Se O42–, Cl O3– | Se O32–, Al O2–, Br –, Cl O3– | ||
| Sn O2, N 2O, Mn O2, S O32– | Cl O3–, S O42–, Ti O+, Mn O4– | ||
| Cl 2O, I 2, N 2O3, Cr 2O72– | I 2, N O, H2 Se, Cr 2O72– |
2. Запишите электронно-ионные уравнения полуреакций, ионное и молекулярное уравнения реакции, соответствующей данному превращению.
| KMnO4 + KI + H2SO4 ®Mn2+, I2 | |
| Na2SeO3 + KВrO + H2O ® Br2, SeO42– | |
| FeSO4 + Br2 + H2SO4 ® Fe3+, Brˉ | |
| KMnO4 + KI + H2O ® MnO2, I2 | |
| KCrO2 + Br2 + KOH ® Br–, CrO42– | |
| FeCl2 + KMnO4 + H2SO4 ® Fe3+, Mn2+ | |
| Na2MnO4 + Na2SO3 + H2O ® MnO2, SO42– | |
| K2Cr2O7 + FeSO4 + H2SO4 ® Cr3+, Fe3+ | |
| KClO3 + KCrO2 + NaOH ® Cl–, CrO42– | |
| CrO3 + HCl ® Cl2, Cr3+ | |
| C + HNO3 ® CO2, NO2 | |
| Cr2(SO4)3 + NaClO + NaOH ® Cl–, CrO42– | |
| KCrO2 + Cl2 + KOH ® CrO42–, Cl– | |
| Ni(OH)2 + NaClO + H2O ® Cl–, Ni(OH)3↓ | |
| KMnO4 + Na2SO3 + H2O ® SO42–, MnO2 | |
| BiCl3 + SnCl2 + KOH ® SnO32–, Bi | |
| Cr2(SO4)3 + Cl2 + KOH ® CrO42–, Cl– | |
| I2 + Cl2 + H2O ®IO3–, Cl– | |
| KClO3 + MnO2 + KOH ® MnO42–, Cl– | |
| Na3AsO3 + K2Cr2O7 + H2SO4 ® AsO43–, Cr3+ | |
| HCl + HNO3 ® Cl2, NO | |
| KMnO4 + KI + NaOH ® MnO42–, IO3– | |
| I2 + Na2SO3 + H2O ® I–, SO42– | |
| FeSO4 + KClO3 + H2SO4 ®Cl–, Fe3+ | |
| KClO3 + I2 + H2O ® IO3–, Cl– | |
| H2S + HNO3 ® SO42–, NO2 | |
| Na3AsO3 + I2 + H2O ® AsO43– , I – | |
| Mn(NO3)2 + NaBiO3 + HNO3 ® Bi3+, MnO4– | |
| KI + HNO3 ® NO, I2 | |
| KMnO4 + V2(SO4)3 + H2O ® MnO2, VO2+ | |
| FeCl2 + HNO3 + HCl ®Fe3+, N2O | |
| К2S + K2MnO4 + H2O ® S, MnO2 | |
| MnSO4 + Cl2 + KOH ® MnO42–, Cl– | |
| H2S + K2Cr2O7 + H2SO4 ® Cr3+, S | |
| K2Cr2O7 + Na2SO3 + H2SO4 ® Cr3+, SO42– | |
| MnO2 + KNO3 + KOH ®MnO42–, NO2 | |
| Fe(NO3)2 + HNO3 ® Fe3+, NO2 | |
| Cl2 + FeCl3 + KOH ® Cl–, FeO42– | |
| K2Cr2O7 + HCl ®Cr3+, Cl2 | |
| FeCl2 + NaBiO3 + NaOH ® Fe(OH)3, BiO+ | |
| SnCl2 + Na3AsO3 + HCl® Sn4+, As | |
| S + KOH® SO32–, S2– | |
| SO2 + NaIO3 + H2O ® I–, SO42– | |
| H2S + HNO3 ® S, NO | |
| KBrO + MnCl2 + KOH ® Br –, MnO42– | |
| K2Cr2O7+ FeSO4 + H2SO4 ® Cr3+, Fe3+ | |
| NaCrO2 + NaClO + KOH ® CrO42–, Cl– | |
| KMnO4 + NaNO2 + H2SO4 ®Mn2+, NO3– | |
| SnCl2 + K2Cr2O7 + H2SO4 ® Sn4+, Cr3+ | |
| Cr2O3 + KNO3 + KOH ® CrO42–, N2 | |
| К2S + KMnO4 + H2SO4 ® Mn2+, SO42– | |
| H2S + Cl2 + H2O ® SO42–, Cl– | |
| HNO3 + Ni ® N2O, Ni2+ | |
| MnO2 + НCl ®Mn2+, Cl2 | |
| FeCl3 + Na2SO3 + H2O ® Fe2+, SO42– | |
| HCl + Ni(OH)3 ® Ni2+, Cl2 | |
| KMnO4 + NaNO2 + H2O ® MnO2, NO3– | |
| SnCl2 +KBrO3 + HCl ® Sn4+, Br – | |
| KMnO4 + H2S + H2SO4 ® Mn2+, SO42– | |
| (BiO)2SO4 + Br2 + NaOH ® BiO3– , Br – |
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 5595; Нарушение авторских прав?; Мы поможем в написании вашей работы!