
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Катодные процессы
|
|
|
|
Электролиз растворов
Задания для самостоятельной подготовки
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П. 7): укажите анод и катод, напишите электронно-ионные уравнения полуреакций анодного и катодного процессов, суммарные ионное и молекулярное уравнения окислительно-восстановительной реакции, протекающей при гальванокоррозии, укажите направление перемещения электронов в системе.
| Коррозионная среда | ||
| H2O + O2 | NaOH + H2O | HCl р-р |
| 1. Fe / Zn | 11. Fe / Cu | 21. Pb / Zn |
| 2. Fe / Ni | 12. Zn / Sn | 22. Al / Cu |
| 3. Pb / Fe | 13. Cd / Cr | 23. Al / Ni |
| 4. Cu / Zn | 14. Al / Cu | 24. Sn / Cu |
| 5. Zn / Fe | 15. Fe / Cr | 25. Co / Al |
| 6. Zn / Al | 16. Al / Fe | 26. Cr / Ni |
| 7. Cr / Cu | 17. Pb / Cr | 27. Al / Fe |
| 8. Cu / Al | 18. Cr / Zn | 28. Fe / Mg |
| 9. Zn / Sn | 19. Mg / Cd | 29. Cr / Bi |
| 10. Co / Mg | 20. Zn / Fe | 30. Pb / Al |
Электролиз – совокупность процессов, протекающих при пропускании электрического тока через раствор или расплав электролита. В случае пропускания электрического тока через водный раствор электролита процесс осложняется возможностью участия в процессе электролиза воды. При электролизе происходит превращение электрической энергии в химическую.
Ячейка для электролиза, называемая электролизером, состоит из емкости, наполненной раствором электролита и двух электродов. Катод – электрод, на котором идет реакция восстановления, у электролизера подключен к отрицательному полюсу источника тока. Анод – электрод, на котором протекает реакция окисления, подключен к положительному полюсу источника тока.
Электроды, используемые в ходе электролиза, можно разделить на активные (расходуемые) и инертные (нерасходуемые). Активным называется анод, материал которого может окисляться в ходе электролиза. Инертным называется анод, материал которого не окисляется в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину.
На катоде могут происходить следующие процессы восстановления:
· восстановление молекул воды (в нейтральной или щелочной среде):
2H2O + 2 ē = H2 + 2OH ,
, 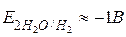
· ионов водорода (в кислой среде):
2H+ + 2 ē = H2
· восстановление ионов металлов:
Меn+ + n ē = Ме
Последовательность, в которой происходит восстановление ионов металлов на катоде из растворов, определяется рядом стандартных электродных потенциалов. Чем левее металл в ряду стандартных потенциалов, тем труднее его ион восстанавливается при электролизе. При этом возможны три случая:
· катионы металлов, имеющих стандартный потенциал больший, чем у водорода (от Н+ до Au3+), при электролизе практически полностью восстанавливаются на катоде, выделения водорода не происходит;
· катионы металлов, имеющих малую величину (менее –1 В) стандартного потенциала (от начала ряда до Mn2+ включительно), не восстанавливаются на катоде, а вместо них восстанавливается водород из молекул воды;
· катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от Mn2+ до Н+), при электролизе на катоде восстанавливаются одновременно с молекулами воды.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 814; Нарушение авторских прав?; Мы поможем в написании вашей работы!