
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения заданий. Пример 1. Гальванопара алюминий-железо в воде (среда нейтральная)
|
|
|
|
Пример 1. Гальванопара алюминий - железо в воде (среда нейтральная). В воде растворен кислород.
Al / H2O, O2 / Fe
1. Потенциалы металлов:
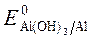 = - 1,88 B;
= - 1,88 B;  = - 0,46B.
= - 0,46B.
2. Потенциалы возможных окислителей (деполяризаторов):
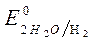 = – 0,41 В;
= – 0,41 В;  = + 0,814 B.
= + 0,814 B.
Al – анод (А); Fe – катод (К)$ окислитель - О2.
3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
 A (Al): 4 Al - 3ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
A (Al): 4 Al - 3ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
 K (Fe): 3 О2 + 4ē + 2Н2 О = 4ОН– - процесс восстановления
K (Fe): 3 О2 + 4ē + 2Н2 О = 4ОН– - процесс восстановления
4. Суммарные ионное и молекулярное уравнения:
 4 Al + 12 Н2О + 3 О2 + 6 Н2О = 4 Al(OH)3+ 12 Н+ + 12 ОН–
4 Al + 12 Н2О + 3 О2 + 6 Н2О = 4 Al(OH)3+ 12 Н+ + 12 ОН–
12 Н2О
4 Al + 3 О 2 + 6 Н2О = 4 Al(OH)3.
5. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом (от анода к катоду):
 ē
ē
 А– Al │ Fe К+ ē
А– Al │ Fe К+ ē
O2, H2O.
Пример 2. Определить процессы, протекающие при коррозии луженого железа (в растворе HCl), если нарушена сплошность покрытия:
Fe / Н2О, НCl / Sn.
1. Потенциалы металлов:
 = - 0,44 B;
= - 0,44 B;  = - 0,136 B.
= - 0,136 B.
2. Потенциалы возможных окислителей (деполяризаторов):
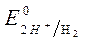 = – 0,00 В
= – 0,00 В
Fe – анод (А); Sn – катод (К); окислитель - H+.
3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
 A (Fe): 1 Fe - 2ē = Fe 2+ –процесс окисления
A (Fe): 1 Fe - 2ē = Fe 2+ –процесс окисления
K (Sn): 1 2Н+ + 2ē = Н2 – процесс восстановления.
 |
4. Суммарные ионное и молекулярное уравнения:
Fe + 2Н+ = Fe2+ + Н2
Fe + 2НCl = FeCl2 + Н2.
5. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом (от анода к катоду):
 ē
ē
 А– Fe │ Sn К+ ē
А– Fe │ Sn К+ ē
Н2О, НCl .
Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
Al / КОН, H2O / Fe
1. Потенциалы металлов:
 = - 2,36 B;
= - 2,36 B; 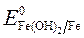 = - 0,874 B.
= - 0,874 B.
2. Потенциал окислителя (деполяризатора):
 = - 0,827 B.
= - 0,827 B.
Al – анод (А); Fe – катод (К); окислитель - Н2О.
 3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
A (Al): 2 Al - 3ē + 4OH – = AlO2– + 2H2O – процесс окисления
 K (Fe): 3 2 H2O + 2ē = 2 OH – + H2 – процесс восстановления.
K (Fe): 3 2 H2O + 2ē = 2 OH – + H2 – процесс восстановления.
4. Суммарные ионное и молекулярное уравнения:
2 Al + 8 OH– + 6 H2O = 2 AlO2– + 4 H2O + 6 OH– + 3 H2
2 Al + 2 OH – + 2H2O = 2 AlO2– + 3 H2
2 Al + 2 КOH + 2H2O = 2 КAlO2 + 3 H2.
5. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом (от анода к катоду):
 ē
ē
 А– Al │ Fe К+ ē
А– Al │ Fe К+ ē
H2O, KOH.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2218; Нарушение авторских прав?; Мы поможем в написании вашей работы!