
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реактиви
|
|
|
|
Розчин нітрату срібла, 0,05 моль-екв/дм3: 8,494 ± 0,001 г AgNO3, х.ч., розчиняють у дистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі. Розчин зберігають у склянці з темного скла. Точну концентрацію розчину встановлюють титруванням за стандартним розчином NaCl.
Розчин хромату калію: 120 г К2СrO4, х.ч., розчиняють у невеликому об'ємі дистильованої води; для видалення хлоридів добавляють розчин AgNO3 до моменту появи червоно-бурого осаду. Через 2 год його фільтрують і доводять об'єм фільтрату дистильованою водою до 1 дм3 у мірній колбі.
Стандартний розчин хлориду натрію, 0,05 моль-екв/дм3: препарат NaCl, х.ч., прожарюють при 500 − 600 °С до повного видалення вологи. 2,922 ± 0,001 г такого NaCl розчиняють у дистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі.
В роботі можна використовувати KCl, наважка якого має бути 3,727 ± 0,001 г.
Активоване вугілля БАУ: наважку активованого вугілля кип'ятять з розчином HCl (1: 3) упродовж 2−3 год. Якщо розчин набуде забарвлення, кип'ятіння повторюють зі свіжим розчином HCl доти, доки розчин над вугіллям не залишатиметься безбарвним. Вугілля промивають дистильованою водою до нейтральної реакції, заливають розчином NaOH концентрацією 2 М і залишають на ніч. Якщо розчин забарвлюється, операцію повторюють. Після повного видалення органічних сполук вугілля промивають дистильованою водою до нейтральної реакції і зберігають під шаром дистильованої води.
Після пропускання кожної проби води колонку з активованим вугіллям промивають 0,1 М розчином NaOH до зникнення забарвлення, а потім дистильованою водою до нейтральної реакції.
Визначення концентрації розчину АgNО3 У конічну колбу піпеткою вносять 15,0 см3 стандартного розчину NаСІ концентрацією 0,05 моль-екв/дм3 і доливають дистильовану воду до об'єму 50 см3. Добавляють 0,5 см3 розчину К2СrO4 і титрують розчином АgNО3, як в методиці визначення.
|
|
|
Концентрацію розчину АgNО3 Сх (моль-екв/дм3) обчислюють за рівнянням
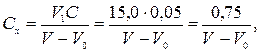
де V1 − об'єм взятого стандартного розчину NаСІ, см3; С − концентрація стандартного розчину NaС1, моль-екв/дм3; V − об'єм розчину АgNО3, витрачений на титрування, см3; Уо − об'єм розчину AgNOз, витрачений на титрування «холостої» проби (дистильованої води), см3.
Меркуриметричне визначення
Принцип методу. Метод полягає в титруванні хлорид-іонів розчином нітрату ртуті(ІІ) за наявності змішаного індикатору дифенілкарбазону з бромфеноловим синім. Під час титрування іони Hg2+ зв'язуються з іонами Сl- у стійкі безбарвні хлоридні комплекси HgCl2, а надлишок іонів Нg2+ після досягнення точки еквівалентності утворює з дифенілкарбазоном менш стійкі забарвлені комплекси.
За меркуриметричного визначення вмісту хлоридів велике значення має кислотність розчину. Оптимальне значення рН (3,0 − 3,5) контролюють за допомогою кислотно-основного індикатору бромфенолового синього, що входить до складу змішаного індикатору.
Зависі, відновники і забарвлені органічні речовини, що заважають аналізу, видаляють так, як зазначено в методиці «Аргентометричне визначення». Аналізу заважають також хромат-іони та іони заліза, якщо їх концентрація більша за 10 мг/дм3.
Мінімальна визначувана концентрація дорівнює 2 мг С1/дм3 за аналізу 100 см3 проби. Якщо вміст хлоридів перевищує 10 мг/дм3, то для аналізу беруть менший об'єм води.
Методика визначення. Пробу води об'ємом 10 − 100 см3, в якій міститься не менш як 0,2 мг С1-, випарюють досуха у фарфоровій чашці на водяній бані. Осад розчиняють за перемішування скляною паличкою у 0,5 см3 розчину азотної кислоти, добавляють 2 см3 етилового спирту і 3 − 4 краплі змішаного індикатору. Якщо при цьому розчин набуває синього відтінку, то по краплі добавляють розчин НNО3 до появи жовтого забарвлення. Якщо після добавляння змішаного індикатору розчин стає жовтим, то по краплі добавляють розчин NaОН до моменту появи синього забарвлення, а потім − розчин НNO3 аж до зміни синього забарвлення на жовте. Так створюється оптимальна кислотність середовища.
|
|
|
Титрування проводять розчином Hg(N03)2 концентрацією 0,005 моль-екв/дм3 з мікробюретки, ретельно перемішуючи розчин скляною паличкою до зміни жовтого забарвлення на фіалкове.
Концентрацію хлоридів Сх (ммоль-екв/дм3) або Су (мг/дм3) обчислюють за рівняннями
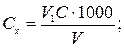
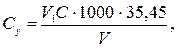
де V 1 — об'єм розчину Hg(N03)2, витрачений на титрування, см3; С — концентрація розчину Hg(N03)2, моль-екв/дм3; V — об'єм проби води, см3; 35,45 — молярна маса еквівалента хлорид-іонів.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!