
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реактиви. Розчин комплексону III, 0,02 моль-екв/дм3; буферний розчин з рН~10; індикатор еріохром чорний Т — приготування див
|
|
|
|
Розчин комплексону III, 0,02 моль-екв/дм3; буферний розчин з рН ~ 10; індикатор еріохром чорний Т — приготування див. у попередній методиці.
Індикатор мурексид: 0,2 г мурексиду С8Н8O7N5∙H2O змішують зі 100 г хлориду натрію і розтирають у порошок у фарфоровій ступці.
їдкий натр, 1 моль-екв/дм3: 40 г NаОН, ч.д.а., розчиняють у дистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі.
Соляна кислота, 1 моль-екв/дм3: 85 см3 концентрованої НСl, ч.д.а., розбавляють дистильованою водою і доводять об'єм розчину до 1 дм3 у мірній колбі.
Бромна вода: 10 г брому енергійно струшують з 200 см3 дистильованої води у склянці з притертою пробкою; пробку зрідка потрібно відкривати. Бром беруть з надлишком, тому частина його осідає на дно склянки. У міру витрачання бромної води добавляють нову порцію дистильованої води, щоразу енергійно струшуючи. Роботи з бромною водою виконують у витяжній шафі.
РОЗДІЛ 2. Біогенні елементи
До біогенних елементів належать азот, фосфор, силіцій та залізо, які входять до складу різноманітних сполук. Вони мають велике значення для розвитку гідробіонтів, від життєдіяльності яких значною мірою залежить формування хімічного складу поверхневих вод суходолу.
Азот. Азот міститься в природних водах у вигляді неорганічних та органічних сполук. Неорганічними формами азоту є іони NH4+, NO2-, NO3- та молекули NH3. В органічних сполуках азот входить до складу білків, амінокислот, амінів, амідів, сечовини, продуктів метаболізму гідробіонтів тощо («органічний азот» Nорг). Неорганічні сполуки азоту, особливо нітрати, засвоюються водяними рослинами в процесі фотосинтезу. Тому за інтенсивної вегетації концентрація нітратів у воді може знижуватись практично до нуля. Неорганічні сполуки азоту з'являються у водах внаслідок біохімічного розкладання азотовмісних органічних сполук. Взаємний перехід одних сполук азоту в інші є складним біохімічним і фізико-хімічним процесом, який у загальному вигляді можна подати схемою
Рослини (тварини) → Продукти розкладання (Nорг)
↑ ↓
NO3-↔ NO2-↔NH4+
Найменш стабільними в умовах природних вод є іони NО2-, які залежно від рН, Eh, концентрації розчиненого кисню та активності водяних бактерій легко окиснюються до NO3- або відновлюються до NH4+. Збільшення концентрації NO2- (й особливо NH4+) є однією з ознак забруднення природних вод.
З неорганічних сполук азоту надзвичайно токсичним є аміак NH3, гранично допустима концентрація якого є найнижчою (0,08 мг/дм3) серед усіх сполук азоту. Співвідношення між вмістом NН3 і значно менш токсичних іонів NH4+ залежить від рН і температури води (див. табл. 1).
Таблиця 1. Відносний вміст NН3 від загального вмісту амонійного азоту,%
| t,°С | рН | ||||||||
| 8,5 | 9,5 | 10,5 | |||||||
| 0,05 | 0,49 | 4,70 | 13,4 | 32,9 | 60,7 | 83,1 | 93,9 | ||
| 0,02 | 0,23 | 2,30 | 6,7 | 19,0 | 42,6 | 70,1 | 88,1 | ||
| 0,01 | 0,11 | 0,90 | 3,3 | 9,7 | 25,3 | 51,7 | 77,0 |
З підвищенням загальної концентрації амонійного азоту до 0,2 мг/дм3 і більше нагромадження значних кількостей токсичного для риб аміаку можна очікувати, якщо рН  9 і температура води висока.
9 і температура води висока.
Крім процесів, які відбиває наведена вище схема, джерелами надходження сполук азоту у природні води є мінеральні добрива, що вимиваються атмосферними опадами з ґрунту, дощові води, які містять продукти окиснення азоту під дією електричних розрядів в атмосфері, промислові азотовмісні викиди, комунально-побутові стоки та ін.
Фосфор. Фосфор міститься в поверхневих водах суходолу у вигляді ортофосфатів, поліфосфатів та органічних сполук (Рорг). Надходять сполуки фосфору в природні води у процесі життєдіяльності гідробіонтів та при мінералізації їхніх решток. Концентрація фосфору зменшується внаслідок споживання, в основному ортофосфатів, водяними рослинами. Ці процеси відбиває така схема:
Рослини (тварини) → Рорг
↑ ↓
Ортофосфати
Основними антропогенними джерелами надходження неорганічних сполук фосфору (ортофосфатів та поліфосфатів) у поверхневі води суходолу є змивання фосфоровмісних добрив дощем із сільськогосподарських угідь, а також стічні води лазне-пральних комбінатів.
Силіцій. Силіцій є постійним компонентом природних вод, оскільки входить до складу різноманітних мінералів, з якими вони контактують. У поверхневих водах суходолу силіцій міститься переважно у формі малорозчинної слабкої ортосиліціевої й полісиліцієвих кислот, а також у колоїдному стані. Вміст розчинених сполук силіцію у поверхневих водах приблизно відповідає розчинності мономерної ортосиліціевої кислоти (~6 мг/дм3). Зменшення концентрації сполук силіцію, особливо у вегетаційний період, засвідчує, що його споживають водяні організми. Крім того, малорозчинна силіцієва кислота як слабкіша може витіснятися з води в осад сильнішою від неї вугільною кислотою.
Залізо. Сполуки заліза у вигляді розчинених форм, колоїдів і суспензій надходять у поверхневі води суходолу внаслідок хімічного вивітрювання гірських порід, що супроводжується їх механічним руйнуванням та розчиненням. Значні кількості сполук заліза надходять також із підземним стоком та зі стічними водами підприємств металургійної й металообробної промисловості. Водночас у природних водах відбуваються біологічні та фізико-хімічні процеси, які супроводжуються споживанням сполук заліза водяними рослинами та його осадженням в основному у вигляді гідроксиду.
За низьких значень рН та Eh, характерних для придонних шарів води, особливо в зимовий період, домінують сполуки двовалентного заліза Fе2+, FеОН+, FеС03 та комплекси з органічними речовинами, здебільшого з фульвокислотами.
Зі збільшенням рН та залізо(ІІ) окиснюється розчиненим у воді киснем до заліза(ПІ), тому для поверхневих вод суходолу з рН  6 і Еh > 200...300 мВ характернішою є наявність сполук заліза(ІІІ). Відповідно до розрахунків з використанням значень добутку розчинності гідроксиду заліза(ІІІ) та констант стійкості гідроксокомплексів, за цих умов у розчині домінують гідроксокомплекси [Fе(ОН)3] й концентрація заліза(ІІІ) теоретично не може перевищувати 0,017 мг/дм3. Однак для поверхневих вод суходолу характерна значно вища концентрація, яка може досягати 2 мг Fе/дм3 і навіть більше. Це свідчить про зв'язування іонів заліза(ІІІ) в розчинні стійкі комплексні сполуки в основному з високомолекулярними органічними речовинами, зокрема з гуміновими та фульвокислотами.
6 і Еh > 200...300 мВ характернішою є наявність сполук заліза(ІІІ). Відповідно до розрахунків з використанням значень добутку розчинності гідроксиду заліза(ІІІ) та констант стійкості гідроксокомплексів, за цих умов у розчині домінують гідроксокомплекси [Fе(ОН)3] й концентрація заліза(ІІІ) теоретично не може перевищувати 0,017 мг/дм3. Однак для поверхневих вод суходолу характерна значно вища концентрація, яка може досягати 2 мг Fе/дм3 і навіть більше. Це свідчить про зв'язування іонів заліза(ІІІ) в розчинні стійкі комплексні сполуки в основному з високомолекулярними органічними речовинами, зокрема з гуміновими та фульвокислотами.
Середній ступінь зв'язування заліза(ІІІ) в комплексні сполуки різних молекулярних мас у природних водах ілюструють такі дані:
Молекулярна
маса, кДа  100 100−10 10−1
100 100−10 10−1  1
1
Зв'язування, % 29,0 32,7 25,3 13,0
Утворення згаданих комплексів значною мірою впливає на аналітичне визначення вмісту заліза в поверхневих водах суходолу.
Лабораторна робота № 4
Визначення вмісту сполук фосфору
У поверхневих водах суходолу сполуки фосфору містяться у розчиненому колоїдно-дисперсному й завислому станах. Ці форми за потреби можна розділити за допомогою мембранних фільтрів. До розчинних форм фосфору належать неорганічні — орто-, піро- й поліфосфати, а також органічні фосфоровмісні сполуки (нуклеїнові кислоти, нуклеопротеїди, фосфорильовані цукри, фосфоліпіди та ін.). Завислі форми фосфору також можуть бути неорганічного (фосфоровмісні мінерали) й органічного (сестон, детрит) походження.
Співвідношення органічних форм фосфору, зокрема ортофосфатів, залежить від рН води (табл. 2.). За значення рН 6,5−8,5, характерного для поверхневих вод суходолу, фосфати містяться в основному у вигляді іонів Н2РO42-. Значну частину фосфору можуть становити поліфосфати, особливо за антропогенного забруднення води, та фосфоровмісні органічні сполуки.
Концентрація сполук фосфору в поверхневих водах зазвичай становить соті і тисячні частки мг Р/дм3, у забруднених водах може досягати кількох мг Р/дм3. Максимальні концентрації сполук фосфору у воді спостерігаються навесні і влітку, мінімальні — восени і взимку.
Таблиця 2. Залежність вмісту (мол. частка, %) різних форм
ортофосфатів від рН води
| Форма ортофос- фату | рН | |||||||
| 8,5 | ||||||||
| H3PO4 | 0,10 | 0,01 | — | — | — | — | — | — |
| Н2РО4- | 97,99 | 83,67 | 33,90 | 4,88 | 1,61 | 0,51 | 0,05 | — |
| НРО42- | 1,91 | 16,32 | 66,10 | 95,12 | 98,38 | 99,45 | 99,59 | 96,53 |
| РО43- | — | — | — | — | 0,01 | 0,04 | 0,36 | 3,47 |
Специфіка визначення різних сполук фосфору у воді полягає в тому, що в процесі попередньої підготовки проб усі вони переходять у молекули ортофосфорної кислоти Н3РО4, вміст яких у подальшому визначають фотометрично в одній і тій же аналітичній формі − продукті відновлення фосфомолібденової гетерополікислоти до молібденової сині. Тому нижня межа визначення всіх сполук фосфору є однаковою за однакового об'єму проб.
Схема аналізу така. Спочатку визначають вміст ортофосфатів С 1 у пробі води, профільтрованій крізь мембранний фільтр із розміром пор 0,45 мкм. Потім у такій же пробі профільтрованої води проводять кислотний гідроліз поліфосфатів, за якого вони розкладаються до ортофосфатів, і визначають вміст останніх С 2, вміст поліфосфатів дорівнює різниці С 2 − C1. Далі визначають загальний вміст розчиненого фосфору С 3 після деструкції поліфосфатів та органічних сполук фотохімічним методом чи методом «мокрого спалювання» з персульфатом. Вміст розчинних органічних сполук фосфору (Рорг) дорівнює різниці С 3 − С 2.
Валовий вміст фосфору визначають у нефільтрованій пробі води, проводячи гідроліз поліфосфатів і деструкцію органічних сполук. Вміст завислих сполук загального фосфору визначають за різницею вмісту валового фосфору і загального розчиненого фосфору. Вміст сполук фосфору в зависях можна також визначити в розчині, отриманому після розчинення мембранного фільтра разом з осадом.
Вміст розчинених ортофосфатів визначають також за експресною тест-методикою.
Сполуки фосфору є біохімічно рухливими компонентами, тому їх бажано визначати у свіжовідібраній пробі води. Якщо це неможливо, то до проби води добавляють 2−4 см3 хлороформу на 1 дм3 і зберігають за температури 3 − 5 °С не довше ніж 3 доби. Вміст усіх форм фосфору виражають у мг Р/дм3.
Інколи вміст фосфору в природних водах виражають у мг РО43-/дм3 або в ммоль-екв РО43-/дм3. Коефіцієнти для перерахунку вмісту фосфору у воді, вираженого в різних одиницях, наведені в табл. 3.
Таблиця 3. Коефіцієнти для перерахунку вмісту фосфору у воді,
вираженого в різних одиницях
| Одиниця | мг Р/дм3 | мг РО43-/дм3 | ммоль-екв РО43-/дм3 |
| 1 мг Р/дм3 | 3,067 | 0,0969 | |
| 1 мг РО43-/дм3 | 0,326 | 0,0316 | |
| 1 ммоль-екв РО43-/дм3 | 10,32 | 31,66 |
Приклад 1. 1 мг РО43-/дм3 = 3,067 мг Р/дм3.
Приклад 2. 1 ммоль-екв РО43-/дм3 = 0,0969 мг Р/дм3
Фотометричне визначення розчинених ортофосфатів
Принцип методу. Внаслідок взаємодії ортофосфатів із молібдатом амонію в кислому середовищі (рН~1) утворюється забарвлена в жовтий колір фосфомолібденова гетерополікислота:
Н3РО4 + 12(NH4)2МоO4 + 24HNO3↔Нз[Р(Мо3О10)4] + 24NH4NO3+ 12Н2O.
Під дією відновника, наприклад аскорбінової кислоти, молібден(VІ) у гетерополікислоті відновлюється до середнього ступеня окислення +5,5, який відповідає суміші еквівалентних кількостей Мо(VІ) і Мо(V). Внаслідок цього утворюється сполука синього кольору − молібденова синь. Інтенсивність забарвлення розчину пропорційна концентрації ортофосфатів.
За наявності стибій(III)тартрату калію до складу забарвленої сполуки входить стибій у співвідношенні Sb: Р = 1: 1. За цих умов реакція відбувається швидко за кімнатної температури; збільшується також інтенсивність забарвлення. Поліфосфати і фосфоровмісні органічні сполуки в реакцію не вступають.
Нижня межа визначення ортофосфатів дорівнює 0,01 мг Р/дм3 за об'єму проби 50 см3. Якщо концентрація силікатів більша за 100 мг Sі/дм3, а заліза(ІІI) − за 1 мг/дм3, то вони заважають аналізу. Вплив силікатів усувають розбавлянням проби води, заліза − добавлянням еквівалентної кількості комплексону III або пропусканням проби крізь колонку, заповнену катіонітом в Н+-формі. Кольоровість води не впливає на результати аналізу.
Методика визначення. У колбу місткістю 100 см3 відбирають 50 см3 профільтрованої проби (або інший об'єм, випарений чи розбавлений до 50 см3 дистильованою водою), добавляють 10 см3 змішаного реактиву і розчин перемішують. Через 10 хв вимірюють його оптичну густину на спектрофотометрі за λ = 682 нм або на фотоелектроколориметрі з червоним світлофільтром (λеф = 670 нм) у кюветі з товщиною поглинального шару 5 см. Розчином порівняння є дистильована вода.
Одночасно проводять «холостий» дослід з дистильованою водою, а отримане значення оптичної густини віднімають від значення оптичної густини проби води.
Якщо значення оптичної густини проби після віднімання значення оптичної густини «холостого» розчину менше за 0,02 або більше за 0,5, то для аналізу беруть відповідно більший або менший об'єм проби.
Вміст ортофосфатів у мг Р/дм3 визначають за калібрувальним графіком.
Побудова калібрувального графіка. Умірні колби місткістю 50 см3 вносять 0; 0,5; 1,0; 2,0; 4,0; 5,0; 7,5; 10,0; 15,0; 20,0 см3 робочого розчину дигідрофосфату калію і доливають до риски дистильованою водою. Концентрація фосфатів в отриманих розчинах дорівнює відповідно 0;0,01; 0,02; 0,04; 0,08; 0,10; 0,15; 0,20; 0,30; 0,40 мг Р/дм3. Далі діють за наведеною методикою визначення.
Для побудови калібрувального графіка на осі абсцис відкладають значення концентрації фосфатів, мг Р/дм3, на осі ординат − різницю значень оптичних густин розчинів, в яких міститься гідрофосфат калію і в яких його немає. Калібрувальний графік будують щоразу безпосередньо перед виконанням аналізу.
Зачення оптичних густин розчинів, за якими побудовано калібрувальний графік, збільшуються приблизно від 0,05 до 0,40 (λеф = 670 нм, l = 5 см).
Вміст ортофосфатів Сх(мг Р/дм3) обчислюють за рівнянням
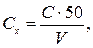
де С − концентрація ортофосфатів, визначена за калібрувальним графіком, мг Р/дм3; V − об'єм проби води, см3.
Коефіцієнти для перерахунку вмісту фосфору у воді, вираженого в різних одиницях, наведені в табл. 3.
Апаратура
Спектрофотометр або фотоелектроколориметр (λ = 682 нм або червоний світлофільтр із λеф = 670 нм). Кювети з товщиною поглинального шару 5 см.
Реактиви
Розчин сірчаної кислоти, 5 моль-екв/дм3: до 400 см3 дистильованої води доливають 70 см3 концентрованої Н2SO4 х.ч. (d = 1,84 г/см3). Після охолодження об'єм розчину доводять до 500 см3.
Розчин молібдату амонію: 20 г (NН4)6Мо7О24∙Н2O, х.ч., розчиняють у 500 см3 дистильованої води. За наявності каламуті розчин потрібно профільтрувати.
Розчин аскорбінової кислоти, 0,1 М: 1,32 г аскорбінової кислоти С6Н8О6, х.ч. або ч.д.а., розчиняють у 75 см3 дистильованої води. Розчин готують у день виконання аналізу.
Розчин стибій(ІІІ)тартрату калію: 0,274 г К(SbО)С4Н406 ∙0,5Н2O, х.ч., розчиняють у дистильованій воді й доводять об'єм розчину до 100 см3.
Змішаний реактив: 125 см3 5 моль-екв/дм3 сірчаної кислоти змішують із 37,5 см3 розчину молібдату амонію, доливають 75 см3 розчину аскорбінової кислоти і 12,5 см3 розчину стибій(Ш)тартрату калію. Цей реактив можна зберігати не довше ніж 24 год.
Стандартний розчин дигідрофосфату калію, 40 мг Р/дм3:0,176 ± 0,001 г КН2Р04, х.ч., попередньо висушеного упродовж 2 год при температурі 105 °С й охолодженого в ексикаторі над СаСІ2, розчиняють у дистильованій воді, добавляють 2 см3 хлороформу і доводять об'єм розчину дистильованою водою до 1 дм3 у мірній колбі.
Робочий розчин дигідрофосфату калію, 0,001 мг Р/см3: 5 см3 стандартного розчину КН2РО4 розбавляють дистильованою водою до 200 см3 у мірній колбі.
Фотометричне визначення розчинених поліфосфатів
Принцип методу. Спочатку проводять кислотний гідроліз поліфосфатів, внаслідок чого утворюються ортофосфати, наприклад:
Na4Р2O7 + 2Н2SO4 + Н2O →2Н3РO4 + 2Na2SО4;
2Nа5Р3O10 + 5Н2SO4 + 4Н2O → 6Н3РO4 + 5Na2SO4 і т.д.
Вміст поліфосфатів визначають за різницею між концентраціями ортофосфатів після (С 2) і до (С 1) гідролізу і виражають у мг Р/дм3.
Нижня межа визначення вмісту поліфосфатів дорівнює 0,02 мг Р/дм3 за об'єму проби 50 см3. Вплив значних кількостей силіцію і заліза, що заважають, усувають, як зазначено в попередній методиці.
Методика визначення. У конічну колбу місткістю 250 см3 вносять100 см3 проби води, профільтрованої крізь мембранний фільтр із діаметром пор 0,45 мкм (або менший об'єм, доведений до 100 см3 дистильованою водою). Потім добавляють 2 см3 34%-го розчину сірчаної кислоти, колбу закривають пробкою-холодильником і кип'ятять упродовж 30 хв. Після охолодження пробу нейтралізують розчином їдкого натру за наявності індикатору фенолфталеїну, переносять у мірну колбу місткістю 100 см3 і доливають дистильованою водою до риски. Якщо після нейтралізації об'єм розчину більший, ніж 100 см3, то його випарюють, охолоджують і доводять до 100 см3 дистильованою водою.
Відбирають 50 см3 розчину і визначають вміст ортофосфатів (див. вище). Вміст поліфосфатів Сх (мг Р/дм3) обчислюють за рівнянням
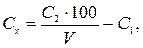
де С 2 − концентрація ортофосфатів у розчині після гідролізу, мг Р/дм3; V − об'єм проби води, взятий для аналізу, см3; 100 — об'єм, до якого розбавлена проба, см3; С 1 — концентрація ортофосфатів у розчині до гідролізу, мг Р/дм3.
Апаратура (див. попередню методику).
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 860; Нарушение авторских прав?; Мы поможем в написании вашей работы!