
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Визначення Кальцію і магнію
|
|
|
|
Іони кальцію надходять у поверхневі води суходолу в основному внаслідок розчинення у воді гірських порід, мінералів, солей тощо. Цьому сприяє наявність у воді розчиненого діоксиду вуглецю (вугільної кислоти), який з іонами Са2+ утворює добре розчинні гідрокарбонати. У річкових водах вміст кальцію не перевищує 1 г/дм3 і зазвичай коливається в межах 10−150 мг/дм3 залежно від гідрологічної ситуації. Якщо ступінь мінералізації води високий, то іони кальцію частково зв'язуються в іонні пари CaSO40, CaCO30, CaHCO3+. У дуже інтенсивно забарвлених водах кальцій утворює досить міцні комплексні сполуки з гумусовими речовинами.
Для визначення концентрації іонів кальцію у поверхневих водах суходолу найбільш простим, точним, селективним і зручним є титриметричний метод із використанням комплексону III та металохромних індикаторів. Комплексна сполука кальцію з комплексоном III дуже стійка, тому часткове зв'язування кальцію в іонні пари та комплекси з гумусовими речовинами не заважає аналізу.
Комплексонометричне визначення кальцію
Принцип методу. Іони кальцію, взаємодіючи з комплексоном III (двонатрієва сіль етилендіамінтетраоцтової кислоти, скорочено Na2Н2Y), утворюють безбарвну, стійку в лужному середовищі (рН 12 − 13) комплексну сполуку складу Са2+: Na2Н2Y = 1: 1 за схемою
Са2+ + H2Y2-↔ CaY2- + 2Н+,
де H2Y2- − аніон комплексону III.
Пробу води, яка містить іони Са2+, титрують розчином комплексону III за наявності індикатору − суміші мурексиду й нафтолового зеленого Б. Іони кальцію утворюють із цим індикатором забарвлені сполуки, які надають розчину брудно-зеленого кольору. Не досягаючи точки еквівалентності, комплексон III зв'язує вільні іони кальцію в безбарвні комплекси CaY2- і колір розчину залишається незмінним. У точці еквівалентності надлишок комплексону III реагує з менш стійкими комплексами кальцію брудно−зеленого кольору, внаслідок чого вивільнюються аніони індикаторів, забарвлені в синій колір.
Іони магнію, концентрація яких не перевищує 3 мг/дм3, не заважають аналізу, оскільки їх сполуки з комплексоном III менш стійкі, ніж комплекси кальцію. Однак, якщо концентрація іонів Mg2+ більша за 3 мг/дм3, то значна кількість гідроксиду магнію, який утворюється при рН 12−13, адсорбує мурексид, що заважає аналізу. Вплив іонів магнію можна усунути розбавлянням проби води дистильованою водою.
Іони важких металів (міді, заліза, мангану, цинку тощо) також утворюють забарвлені комплексні сполуки з мурексидом, але через низьку концентрацію ними можна знехтувати. Якщо води забруднені іонами важких металів, їх можна маскувати добавлянням до проби 0,5−1 см3 25%-го водного розчину триетаноламіну.
Комплексонометричне титрування використовують для аналізу вод із вмістом кальцію не менш як 0,5 мг/дм3.
Методика визначення. У конічну колбу місткістю 150−200 см3 піпеткою вносять 25−100 см3 проби залежно від очікуваного вмісту кальцію, добавляють 2 см3 розчину NaOH для створення рН 12−13 і 10−15 мг сухого змішаного індикатору. Пробу титрують розчином комплексону III за постійного перемішування до зміни брудно-зеленого забарвлення на синє.
Концентрацію іонів кальцію Сх (ммоль-екв/дм3) та Су (мг/дм3) обчислюють за рівняннями
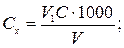
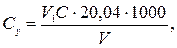
де V 1 − об'єм розчину комплексону III, витрачений на титрування, см3; С − концентрація розчину комплексону III, моль-екв/дм3; V — об'єм проби води, см3; 20,04 − молярна маса еквівалента кальцію (M∙ 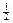 Са2+).
Са2+).
Реактиви.
Розчин комплексону III, 0,02 моль-екв/дм3: 3,75 ± 0,01 г комплексону III (двонатрієва сіль етилендіамінтетраоцтової кислоти С10Н14О8N2Na2∙2H2O) розчиняють у бідистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі. Точну концентрацію розчину встановлюють титруванням стандартним розчином хлориду цинку.
Визначення точної концентрації розчину комплексну ІІІ. У конічну колбу для титрування піпеткою вносять 10 см3 стандартного розчину хлориду цинку з відомою концентрацією С, добавляють 20-25 см3 дистильованої води, 5 см3 буферного розчину з рН~10, 2-3 краплі індикатору еріохром чорний Т і титрують розчином комплексну ІІІ до зміни червоно-фіолетового забарвлення на блакитне.
Концентрацію розчину комплексну ІІІ Сх (моль-екв/дм3) обчислюють за рівнянням
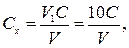
де V1 − об’єм взятого стандартного розчину хлориду цинку, см3; С − концентрація стандартного озчину хлориду цинку, моль-екв/дм3; V − об'єм розчину комплексону ІІІ витраченого на титрування, см3.
Стандартний розчин хлориду цинку, 0,01 моль-екв/дм3: близько 0,33 г металічного гранульованого цинку швидко промивають у невеликій кількості концентрованої соляної кислоти й відразу відмивають від кислоти бідистильованою водою. Потім висушують у сушильній шафі при 100 °С упродовж 1-2 год, охолоджують і визначають його масу (m) на аналітичних терезах.
У мірну колбу місткістю 1 дм3 наливають 10-15 см3 бідистильованої води та 3 см3 концентрованої соляної кислоти і добавляють наважку (m) металічного цинку. Після повного розчинення наважки розчин доливають до риски бідистильованою водою. Концентрація цього розчину приблизно дорівнює 0,01 моль-екв Zn2+/дм3.
Точну його концентрацію С (моль-екв/дм3) обчислюють за рівнянням:
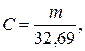
де m − наважка металічного цинку, г; 32,69 − молярна концентрація цинку (М·1/2Zn2+).
Індикатор еріохром чорний Т, спеціальний ЕТ-00 (хромоген чорний), С20Н12O7N3SNa готують одним із таких способів:
а) 0,5 г індикатору розчиняють у 10 см3 буферного розчину і доводять об'єм розчину етиловим спиртом до 100 см3 у мірній колбі;
б) 0,5 г індикатору розтирають у фарфоровій ступці з 50 г хлориду натрію.
Змішаний індикатор: 0,2 г мурексиду С8Н8O7N5∙H2O і 0,5 г нафтолового зеленого Б розтирають у ступці зі 100 г хлориду натрію/ Суміш зберігають у пляшці з темного скла.
Розчин їдкого натру, 2 моль-екв/дм3: 80 г NаОН, х.ч., розчиняють у дистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі.
Буферний розчин з рН~10: 20 г хлориду амонію, х.ч., розчиняють у дистильованій воді, добавляють 100 см3 концентрованого розчину аміаку, х.ч., і доводять об'єм розчину до 1 дм3 у мірній колбі. Якщо рН суміші відрізняється від 10 більш ніж на ±0,2, то добавляють концентрований розчин НС1 або NН4ОН до досягнення рН 10 ± 0,2 за рН-потенціометричного контролю.
Комплексонометричне визначення магнію
Магній, аналогічно кальцію, надходить у природні води внаслідок хімічного вивітрювання та розчинення різноманітних гірських порід, мінералів і солей, а також із промисловими стічними водами. У річкових водах вміст магнію коливається від кількох міліграмів до кількох десятків міліграмів на кубічний дециметр (мг/дм3). У поверхневих водах суходолу вміст магнію, як правило, менший, ніж вміст кальцію. Значна частина магнію знаходиться у вигляді іонних пар (МgSO40, МgНСО3+) та комплексних сполук з органічними речовинами природних вод.
Вміст магнію в природних водах визначають розрахунковим способом та методом прямого комплексонометричного титрування.
Іонні пари та комплекси з органічними речовинами природних вод, які утворюють іони магнію, не заважають аналізу, оскільки комплекс магнію з комплексоном III дуже стійкий.
Визначення розрахунковим способом
У досліджуваній пробі води комплексонометрично визначають загальну твердість Ст (ммоль-екв/дм3) і вміст іонів кальцію 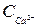 (ммоль-екв/дм3).
(ммоль-екв/дм3).
Вміст іонів магнію Сх (ммоль-екв/дм3) та Су (мг/дм3) обчислюють за рівняннями
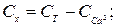
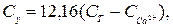
де 12,16 − молярна маса еквівалента магнію (М∙ 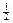 Мg2+).
Мg2+).
Пряме комплексонометричне титрування
Принцип методу. Метод ґрунтується на подвійному титруванні розчином комплексону III: спочатку пробу титрують за рН 12-13 і наявності індикатору мурексиду, при цьому зв'язуються іони кальцію. Потім створюють рН ~ 10 і титрують іони магнію за наявності індикатору еріохром чорного Т. Сумарна витрата розчину комплексону III відповідає твердості води.
За наявності іонів металів, комплекси яких з еріохром чорним Т міцніші, ніж із комплексоном III, зміна кольору розчину в точці еквівалентності недостатньо чітка. Визначенню також заважають іони заліза концентрацією понад 10 мг/дм3, кобальту, нікелю, міді (концентраціями кожного понад 0,1 мг/дм3) та деякі ін. Для маскування катіонів металів, які заважають аналізу, застосовують ціанід калію, солянокислий гідроксиламін або сульфід натрію. Така потреба постає в основному при аналізі стічних вод.
Дуже каламутні води фільтрують крізь мембранний фільтр із діаметром пор 0,45 мкм.
Цим методом можна визначати вміст магнію концентрацією від 1 до 50 мг/дм3 за об'єму проби 100 см3.
Методика визначення. У конічну колбу для титрування вносять 100 см3 проби, додають 2 см3 розчину NаОН, 0,1−0,2 г мурексиду і титрують розчином комплексону III до появи інтенсивного фіолетового забарвлення. Витрачений об'єм розчину комплексону III відповідає вмісту кальцію у пробі.
Після титрування розчин нейтралізують додаванням 1,5−2,5 см3 розчину соляної кислоти до рН 7−8, нагрівають і вносять краплю бромної води для розкладання індикатору. Розчин охолоджують, добавляють 5 см3 буферного розчину з рН ~ 10, близько 0,1 г еріохром чорного Т і титрують розчином комплексону III доти, доки фіолетове забарвлення не зміниться на блакитне.
Концентрацію іонів магнію Сх (ммоль-екв/дм3) та Су (мг/дм3) обчислюють за рівняннями
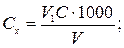
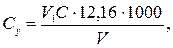
де V 1 − об'єм розчину комплексону III, витрачений на титрування з індикатором еріохром чорним Т, см3; С − концентрація розчину комплексону III, моль-екв/дм3; V − об'єм проби води, см3; 12,16 − молярна маса еквівалента іонів магнію (М∙ 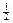 Мg2+).
Мg2+).
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 5383; Нарушение авторских прав?; Мы поможем в написании вашей работы!