
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поляризуемость
|
|
|
|
ПРИНЦИП ГИЛЛЕСПИ
Очень простой способ предсказания валентных углов был разработан Гиллеспи. В основе способа лежит модель отталкивания локализованных электронных пар. Для молекул и ионов с большей атомностью число осей симметрии можно определить по формуле:
n=n2e – nп ,
где n-число осей симметрии центрального атома;
n2e - число электронных пар у центрального атома;
nп, число Пи-связей у центрального атома. Например: Н2SO4


 Н — O O n = 6-2=4 форма молекулы тетраэдрическая
Н — O O n = 6-2=4 форма молекулы тетраэдрическая


 S
S
Н — O O
Связь между атомами различных элементов всегда более или менее полярна. Для характеристики реакционной способности молекул необходимо знать не только исходное распределение плотности электронных облаков, но и легкость с которой оно изменяется. Мерой последней является поляризуе-мость. Поляризуемость -это способность связи становится полярной под действием внешнего поля.
РАСТВОРЫ
Растворами называются гомогенные системы, состоящие из двух или более компонентов и продуктов их взаимодействия. Растворение веществ в воде- это физико-химический процесс, при котором под влиянием молекул растворителя в растворенном веществе разрываются связи между частицами и образуются химические соединения растворяемого вещества и раствори-теля (сольваты и гидраты, если растворитель вода). Затем гидратированные частицы равномерно распределяются по всему объему раствора.
Растворение может быть как эндотермическим, так и экзотермическим процессом, поскольку разрушение структуры растворенного вещества происходит с поглощением определенного количества тепла (+ Н), а взаи-модействие растворителя с частицами растворенного вещества сопровожда-ется выделением тепла (- Н). В зависимости от того, какие процессы пре-обладают при растворении, тепловой эффект процесса положительный или отрицательный.
Способность вещества растворяться в данном растворителе характеризу-ется растворимостью. Растворимостью называется число, показывающее, сколько граммов растворенного вещества может раствориться в 100 г раст-ворителя при данной температуре. Растворимость вещества зависит от при-роды вещества, температуры, давления.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Вещества, растворы которых полностью или частично состоят из ионов, называются электролитами. Распад молекул на ионы называется электролитической диссоциацией. При изучении этой темы необходимо обратить внимание на следующее:
1. Диссоциация двух и более основных кислот и двух и более кислотных оснований протекает ступенчато. Например:
Н3РО4 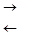 Н+ + Н2РО4-
Н+ + Н2РО4-
Н2РО4 ¯ 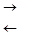 Н+ + НРО42-
Н+ + НРО42-
НРО42 ¯ 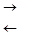 Н+ + РО43-
Н+ + РО43-
Ba(ОH)2 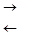 BaOН+ + OH-
BaOН+ + OH-
BaOH+ 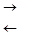 Ba2+ + OH-.
Ba2+ + OH-.
2. В соответствии с величиной степени электролитической диссоци-ации (ά) электролиты делятся на сильные, средней силы и слабые. У силь-ных электролитов ά больше 30 %, у слабых - до 3 %. К сильным электроли-там относятся все растворимые соли, сильные кислоты (НСl, HNO3, H2SO4),
а также все растворимые основания (кроме NH4С1).
Слабые электролиты диссоциируют частично, процесс диссоциации является обратимым. Например:
СН 3СООН 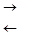 CH 3 COO¯ + Н+,
CH 3 COO¯ + Н+,
К слабым электролитам относятся следующие вещества:
Н2О, NH4OH, H2S, H2CO3, HNO2, CH3COOH.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 383; Нарушение авторских прав?; Мы поможем в написании вашей работы!