
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей. Реакции обмена в растворах электролитов протекают до конца если образуются : осадки, газы, слабые электролиты
|
|
|
|
РЕАКЦИИ ОБМЕНА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Реакции обмена в растворах электролитов протекают до конца если образуются: осадки, газы, слабые электролиты, комплексные ионы.
При этом сильные электролиты записываются в виде ионов, слабые в виде молекул. К сильным электролитам относятся:
-основания, растворимые в воде (кроме NH4OH);
-сильные кислоты (H2SO4, HCI,, HNO3 и др.);
-соли, растворимые в воде.
Например:
1. Реакции с образованием осадков
3СаС12 + 2К3РО4 = Са3(РО4)2 ↓ +6НС1,
3Са2+ + 2РO43- = Са3(РO4)2↓
При записи ионов первым записывается катион.
2. Реакции с выделением газов:
СаS + H2SO4 = CаSO4 + H2S ↑,
CаS + 2H+ = Cа2+ + H2S ↑,
3. Реакция, протекающие с образованием слабого электролита:
H2SO4 + 2NaOH = Na2 SO4 + 2H2О,
Н+ + ОН- = Н2О,
4. Реакция, протекающие с образованием комплексных ионов:
Zn(OH)2 + 2NaOH = Na2 [Zn(OH)4]
Zn(OH)2 + 2 OH- = [Zn(OH)4] 2-.
Вода - слабый электролит и диссоциирует по уравнению:
Н2О 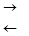 H+ + OH-
H+ + OH-
Произведение концентрации ионов водорода и ионов гидроксила на-зывается ионным произведением воды. Это величина постоянная при постоянной температуре:
[Н+] [ОН-] = 10-14 моль/л,
[Н+] = [ОН-] = 10-7 моль/л,
отсюда:
[Н+] = 10-7 моль/л - среда нейтральная,
[Н+] > 10-7 моль/л - среда кислая,
[Н+] < 10-7 моль/л - среда щелочная.
Отрицательный десятичный логарифм концентрации ионов водорода называется водородным показателем:
pН = - lg [Н+]
Тогда рН различных растворов будет иметь следующие значения: кислого рН < 7, нейтрального рН = 7, щелочного рН > 7.
Гидролизом с оли называется взаимодействие ионов растворенной соли с ионами воды, сопровождающееся изменением рН раствора. Гидролиз может происходить только тогда, когда из ионов соли и ионов воды образуются малодиссоциирующие вещества. .
1. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются.
NaCl + H2O 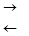
2. Гидролиз солей, образованных сильной кислотой и слабым основанием, протекает по катиону с образованием основных солей.
FeCl3 + Н2О 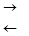 FeOHCl2 + НС1,
FeOHCl2 + НС1,
Fe3+ + НОН 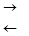 (FeOH)2+ + H+ (pH < 7),
(FeOH)2+ + H+ (pH < 7),
3. Гидролиз солей, образованных сильным основанием и слабой кислотой, протекает по аниону с образованием кислых солей.
Na2CO3 + Н2О 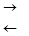 NaHCO3 + NaOH,
NaHCO3 + NaOH,
СО32- + НОН 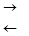 НСО3- + ОН- (рН > 7).
НСО3- + ОН- (рН > 7).
4. Соли, образованные слабым основанием и слабыми кислотами, подвергаются полному гидролизу.
2AlCl3 + 3Na2S + 6Н2О = 2Al(OH)3↓ + 3H2S ↑ + 6NaCl,
2Al 3+ + 3S2- + 6Н2О = 2Al(OH)3↓ + 3H2S ↑.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 394; Нарушение авторских прав?; Мы поможем в написании вашей работы!