
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые равновесия и фазовые превращения
|
|
|
|
Фазой называют совокупность частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом состоянии.
Савельев: фаза – совокупность однородных, одинаковых по своим свойствам частей системы.
Пример: если в закрытом сосуде содержится какая-либо жидкость (например, ацетон), то мы имеем дело с двухфазной системой (жидкой фазой – ацетоном и газообразной фазой – смесью паров ацетона с воздухом).
Понятие «фаза» не тождественно понятию «агрегатное состояние вещества». Различают 3 агрегатных состояния вещества: твердое, жидкое, газообразное (часто считают плазму 4-м состоянием вещества). Так углерод, находясь в одном агрегатном состоянии (твердом), может существовать в двух фазах (графит, алмаз), лед в твердом состоянии имеет не менее 5 фаз (модификаций).
Переход вещества из одной фазы в другую фазу называют фазовым переходом. Фазовый переход приводит к качественному изменению свойств вещества. Например, фазовый переход льда в воду сопровождается изменением агрегатного состояния, объема, плотности, удельной теплоемкости и т.д.
Фазовые переходы делят на 2 вида: 1) фазовый переход I рода;
2) фазовый переход II рода.
К фазовым переходам I рода относят процессы, сопровождающиеся поглощением или выделением некоторого количества теплоты. Это количество теплоты называют теплотой фазового превращения или теплотой фазового перехода. Фазовый переход I рода происходит при постоянной температуре (например, плавление льда при 0ºС, плавление олова при 232ºС, конденсация паров воды при 100ºС, кипение спирта при 78ºС и т.д.).
Фазовые переходы I рода связаны с изменением энтропии и объема. Так, если мы проведем процесс плавления льда (будем плавить лед) то при 0ºС ему нужно подвести некоторое количество теплоты для того, чтобы разрушить кристаллическую решетку. Поэтому подводимая теплота идет не на нагревание льда, а на разрыв межмолекулярных связей. Поэтому плавление льда происходит при постоянной температуре согласно II закона термодинамики.
При фазовом переходе твердое тело - жидкость, то есть при плавлении, система переходит из более упорядоченного состояния в менее упорядоченное, следовательно, энтропия системы будет возрастать, согласно II закона термодинамики.
Если провести процесс кристаллизации (перевести воду в лед при 0ºС), то теплота будет выделяться, система будет переходить в более упорядоченное состояние, следовательно, энтропия будет уменьшаться.
Существуют переходы из одной модификации в другую, не связанные с поглощением или выделением теплоты. Такие переходы называют фазовыми переходами II рода. При таких переходах остаются неизменными объем и энтропия системы, но скачком изменяется теплоемкость. Примеры фазовых переходов II рода: переход некоторых металлов и сплавов при очень низкой температуре (близкой к нулю Кельвина) в сверхпроводящее состояние (происходит резкое уменьшение удельного сопротивления) – в настоящее время интенсивно исследуются керамические материалы, обладающие сверхпроводимостью при температурах выше 100 К; превращение железа (кобальта, никеля, некоторых редкоземельных элементов, ряда сплавов, т.е. ферромагнетиков) в точке Кюри из ферромагнитного состояния в парамагнитное, переход жидкого гелия (гелия-I) при температуре, близкой к 0 К в другую модификацию – в жидкий гелий II.
Для того чтобы описать состояние какого-либо вещества и происходящие в нем фазовые переходы воспользуемся диаграммой состояний (диаграммой фазовых переходов).
Возьмем жидкость и находящийся с ней в равновесии насыщенный пар. Не изменяя объема, будем отнимать у пара тепло. Этот процесс будет сопровождаться понижением температуры (Т) вещества и давления (р). Поэтому точка, изображающая состояние вещества, на диаграмме (р, Т) будет перемещаться вниз по кривой испарения, достигая температуры кристаллизации (Т крист). Пока идет процесс кристаллизации Т и р остаются неизменными. Отводимое при этом тепло является теплом, выделяющимся при кристаллизации. Т крист и соответствующее ей давление р крист - это такие единственные значения температуры и давления, при которых могут находиться в равновесии твердая, жидкая и газообразная фазы вещества.

При дальнейшем отводе тепла от системы температура и давление опять будут уменьшаться. Точка на диаграмме, изображающей состояние вещества перемещается по кривой сублимации вниз (сублимация – это переход без плавления из твердого состояние в газообразное).
Температура тройной точки показывает температуру, при которой происходит плавление вещества при давлении, равном 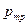 . При других давлениях температура плавления будет другой. Кривая плавления показывает связь между давлением и температурой плавления (она определяет условия равновесия двух фаз – твердой и жидкой).
. При других давлениях температура плавления будет другой. Кривая плавления показывает связь между давлением и температурой плавления (она определяет условия равновесия двух фаз – твердой и жидкой).
Кривые плавления, испарения и сублимации, показанные на рисунке, разбивают координатную плоскость на область твердой фазы, область жидких состояний, область газообразных состояний. Каждая точка на диаграмме соответствует определенному равновесному состоянию вещества. В связи с этим, эту диаграмму называют диаграммой состояния.
Тройная точка изображает равновесие трех фаз - твердой, жидкой и газообразной. Точка на любой линии, разграничивающих области – равновесие двух фаз. Точка в одной из трех областей – изображает однофазное состояние вещества.
Кривая испарения заканчивается в критической точке К, кривая плавления уходит в бесконечность, кривая сублимации - в точку, где р =0 и Т =0.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1242; Нарушение авторских прав?; Мы поможем в написании вашей работы!