
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изотермы Ван-дер-Ваальса
|
|
|
|
Запишем уравнение Ван-дер-ваальса  . Умножив правую и левые части уравнения на
. Умножив правую и левые части уравнения на  , получим
, получим 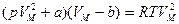 .
.
Раскроем скобки 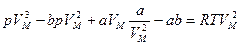 .
.
Перепишем это уравнение в виде  (1).
(1).
Это уравнение при фиксированных значениях р и Т имеет 3 решения. Причем в зависимости от значений р и Т либо все решения вещественные, либо 1 решение вещественное и 2 мнимых.
|
 (давление, молярный объем) при заданных температурах построить график зависимости
(давление, молярный объем) при заданных температурах построить график зависимости  для 1 моля реального газа, то мы получим набор графических зависимостей.
для 1 моля реального газа, то мы получим набор графических зависимостей.
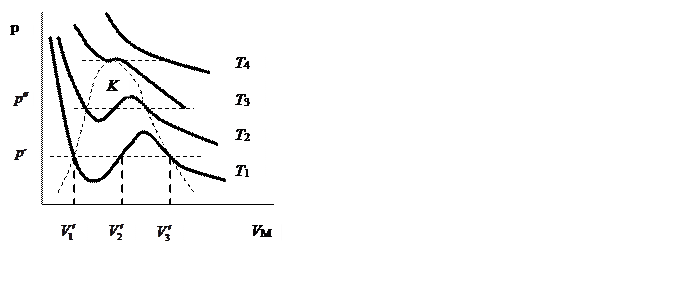
При повышении температуры объемы 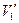 ,
, 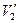 и
и 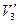 все больше сближаются и при критической температуре сливаются в одну точку, называемую критической точкой. Эта точка является точкой перегиба для критической изотермы.
все больше сближаются и при критической температуре сливаются в одну точку, называемую критической точкой. Эта точка является точкой перегиба для критической изотермы.
Покажем критическую температуру и критическое давление для различных газов:
| Т КР, 0С | Р КР, атм | |
| Н2О | ||
| СО2 | 72,8 | |
| О2 | -118 | |
| Н2 | -240 | 12,8 |
| Не | -268 | 2,3 |
При высоких температурах  изотермы реального газа будут несколько отличаться от изотермы реального газа, оставаясь монотонно спадающей кривой.
изотермы реального газа будут несколько отличаться от изотермы реального газа, оставаясь монотонно спадающей кривой.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 320; Нарушение авторских прав?; Мы поможем в написании вашей работы!
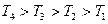 . При низких температурах фиксированному давлению
. При низких температурах фиксированному давлению 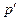 отвечают 3 объема
отвечают 3 объема 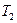 ). Начиная с некоторой температуры
). Начиная с некоторой температуры  (это своя температура для каждого газа) при любом давлении вещественным оказывается только одно решение. Эта температура называется критической.
(это своя температура для каждого газа) при любом давлении вещественным оказывается только одно решение. Эта температура называется критической.