
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства спиртов
|
|
|
|
Ранее было отмечено, что в структуре молекул спиртов «заложены» те или иные свойства, обусловленные наличием гидроксильной группы. К таким свойствам относятся
Кислотность гидроксильной группы;
Возможность замещения гидроксильной группы (Реакции нуклеофильного замещения);
Свойства спиртов как нуклеофильных реагентов (Реакции нуклеофильного замещения);
Основность спиртов;
Способность спиртов к дегидратации.
Химические свойства спиртов можно представить следующей схемой, которая отражает основные превращения гидроксильной группы.
Спирты сами являются слабыми кислотами. Поэтому под действием сильных оснований (металлорганических соединений, в том числе реактивов Гриньяра, гидридов или амидов металлов) спирты превращаются в сопряжённые основания – алкоголяты металлов. Эти же основания могут быть получены при растворении щелочного металла в спирте с выделением водорода. Скорость растворения металла и величина экзотермического эффекта определяются величиной кислотности спирта и активностью металла. Так, обрезки металлического натрия уничтожают растворением в этиловом спирте, тогда как более активный калий растворяют в трет -бутиловом спирте (менее сильной кислоте). А что произойдет, если вместо спиртов попробовать погасить остатки щелочных металлов водой?
Участие спиртов в реакциях нуклеофильного замещения.
1. Гидроксильную группу можно заместить. При этом атаке должен подвергаться атом углерода, несущий гидроксильную группу, которая как бы «выталкивается» из спирта. Поскольку этот атом несет частичный положительный заряд (вследствие отрицательного индуктивного эффекта (-I) атома кислорода гидроксильной группы), атакующий реагент должен быть нуклеофилом. Происходит реакция нуклеофильного замещения.
Проблема: вытесняемая гидроксильная группа не желает «уходить» в виде аниона OH- (сильный нуклеофил, так как заряжен, да и заряд находится на очень электроотрицательном атоме кислорода).
Решение проблемы: превратить «упрямую» гидроксильную группу в «покладистую». Такой способ называют активацией уходящей группы. Этого достигают одним из двух способов. Самый простой – кислотный катализ: кислота протонирует гидроксильную группу – и уходящей группой является вода.
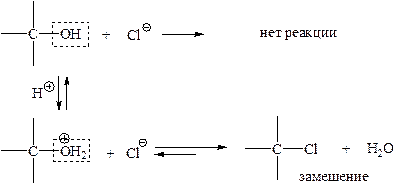
Альтернатива – модификация гидроксильной группы, например, посредством реакции с пара -толуолсульфонилхлоридом. При этом образуется сложный эфир спирта и пара -толуолсульфокислоты. Размер уходящего аниона увеличивается во много раз, в анионе появляется сопряжение, которое значительно уменьшает заряд на атоме кислорода, следовательно, и нуклеофильные свойства.
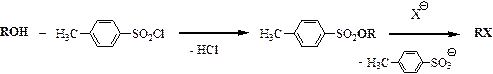
2. Спирт тоже нуклеофильный реагент. Положительный индуктивный эффект алкильной группы (+I) приводит к увеличению частичного отрицательного заряда на атоме кислорода гидроксильной группы спирта, который, следовательно, является более сильным нуклеофилом, чем вода. Поэтому спирт способен вступать в реакции нуклеофильного замещения и как нуклеофил, например, по отношению к алкилгалогенидам (реакция Вильямсона). Реакцию обычно проводят в присутствии основания, роль которого состоит в превращении спирта в алкоголят (который заряжен и, следовательно, более сильный нуклеофил)[8] и связывании кислоты, выделяющейся в реакции.
Спирты являются органическими основаниями, поэтому для них характерны реакции с органическими и неорганическими кислотами. Кислота диссоциирует с образованием протона, который присоединяется к неподеленной электронной паре атома кислорода гидроксильной группы спирта. Ряд основности спиртов прямо противоположен ряду кислотности спиртов.
Спирты способны к дегидратации. Как Вы помните, одним из методов получения алкенов является дегидратация спиртов, т.е. отщепление молекулы воды. Дегидратацию проводят в кислой среде при сильном нагревании. Необходимым условием является наличие у атома углерода, соседнего с несущим гидроксильную группу, атома водорода. Если таких атомов несколько, то преимущественно образуется более замещенный алкен из нескольких возможных (правило Зайцева).
Реакции спиртов
Спирты реагируют с кислотами. При этом происходит нуклеофильное замещение гидроксильной группы спирта на кислотный остаток с отщеплением молекулы воды. Таким образом, реакция спиртов с галогеноводородами приводит к алкилгалогенидам, а реакция спиртов с кислородсодержащими кислотами дает сложные эфиры.
Алкилгалогениды также могут быть получены при действии на спирты галогенидов фосфора, оксохлорида фосфора (POCl3) или хлористого тионила (SOCl2). Другим продуктом реакции являются фосфорные кислоты или диоксид серы соответственно.
Сложные эфиры также могут быть получены взаимодействием спиртов с галогенангидридами и ангидридами кислот.
Реакция спиртов с карбонильными соединениями (альдегидами и кетонами) в присутствии кислоты или основания происходит как нуклеофильное присоединение и приводит к образованию полуацеталей или полукеталей. В кислой среде процесс идёт глубже, сопровождается дегидратацией и приводит к образованию ацеталей и кеталей.
Кислоты также часто выступают в качестве катализатора превращений спиртов для активации гидроксильной группы спирта в реакциях нуклеофильного замещения (см. природа кислотного катализа). Например, в кислой среде спирты реагируют между собой с образованием простых эфиров.
Альтернативный подход к получению простых эфиров заключается в реакции спиртов с алкилгалогенидами. При этом спирт выступает в качестве нуклеофила (за счет неподеленной пары электронов атома кислорода), а алкилгалогенид – в роли электрофила (за счет частичного положительного заряда на атоме углерода, связанного с более электроотрицательным атомом галогена).
Сильное нагревание спирта в серной или фосфорной кислоте приводит к алкенам в результате реакции дегидратации.
Схема Химические свойства спиртов
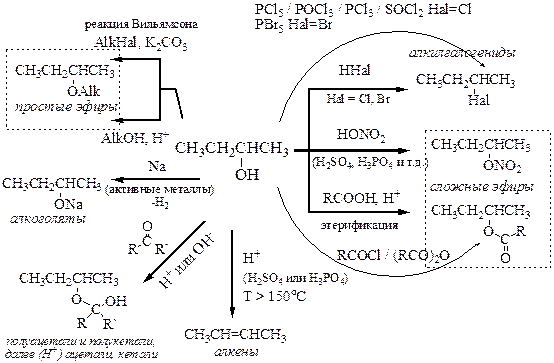
Как Вы видите, химия спиртов богата, интересна, разнообразна. Почему? Благодаря неподелённым парам атома кислорода спирты в химической реакции обычно выступают в качестве нуклеофилов и оснований. При этом, в отличие от алкенов и аренов – π-нуклеофилов (π-оснований), спирты являются n -нуклеофилами (n -основаниями). Символы π и n показывают, на каких орбиталях расположены электроны, «ответственные» за проявление свойств: π-связь непредельных и ароматических углеводородов или неподелённые пары гетероатома.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2096; Нарушение авторских прав?; Мы поможем в написании вашей работы!