
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения средних солей
|
|
|
|
Соли
Способы получения кислот
Кислоты получают:
· взаимодействием ангидридов кислот с водой:
SO3 + H2O = H2SO4
· взаимодействием солей с кислотами:
2NaCl + H2SO4 = 2HCl + Na2SO4
Na2S + H2SO4 = H2S + Na2SO4
· окислением некоторых простых веществ – при действии сильных окислителей на некоторые неметаллы получаются кислоты:
J2 +5Cl2 + 6H2O = 2HJO3 + 10HCl
· взаимодействием неметаллов с водородом (при этом получают безкислородные соединения, водные растворы которых являются кислотами).
H2 + Cl2 = 2HCl
Молекулы солей состоят из ионов металла и кислотного остатка. Соли можно рассматривать как продукты полного или частичного замещения атомов водорода в молекуле кислоты на металл (H2SO4 → NaHSO4 → Na2SO4) или замещения гидроксогруппы в основании на кислотный остаток (Mg(OH)2 → MgOHCl → MgCl2).
Классификация солей
В зависимости от состава различают следующие типы солей: средние, кислые и основные.
Средними (нормальными) солями называются продукты полного замещения атомов водорода кислоты атомами металлов или продукты полного замещения гидроксильных групп в молекуле основания кислотными остатками.
Например: Na2SO4, K2S, NH4Cl и другие.
Иногда ион металла в средней соли бывает связан с двумя различными кислотными остатками, такие соли называются смешанными.
Например: CaOCl2 - соль двух кислот: хлорноватистой и хлороводородной (соляной).
Если ионы водорода многоосновной кислоты замещены двумя различными металлами, то такую соль называют двойной.
Например: NaKCO3 Na2NH4PO4 KAl(SO4)2 и другие.
Двойные и смешанные соли известны как индивидуальные соединения только в кристаллическом состоянии.
1. Взаимодействием оснований с кислотами (реакция нейтрализации):
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2. Из оксидов:
· взаимодействием основных оксидов с кислотами:
CaO + 2HCl = CaCl2 + H2O
· взаимодействием кислотных оксидов с основаниями:
CO2 + Ca(OH)2 = CaCO3 + H2O
· взаимодействием основных оксидов с кислотными:
CaO + CO2 = CaCO3
3. Из металлов:
· взаимодействием металла с неметаллом получают некоторые соли безкислородных кислот:
Zn + S = ZnS
· взаимодействием металлов, находящихся в ряду напряжений левее водорода, с кислотами не окислителями:
Zn + H2SO4(разб.) = ZnSO4 + H2
· взаимодействием металлов с солями:
Zn + CuSO4 = ZnSO4 + Cu
4. Из солей, когда один из продуктов должен удаляться из зоны реакции:
· взаимодействием соли с другими солями (реакция обмена):
AgNO3 + NaCl = AgCl↓ + NaNO3
· взаимодействием соли с основанием:
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
· взаимодействием соли с кислотой:
CaCO3 + 2HCl = CaCl2 + H2CO3(H2O + CO2↑)
· взаимодействием двух солей (комплексное образование):
CuCl2 + 2KCl = K2[CuCl4]
· взаимодействием двух солей (присоединение):
K2SO4 + Al2(SO4)3 = 2KAl(SO4)2
5. Термическим разложением солей. При нагревании некоторых кислородсодержащих солей образуются новые соли с меньшим содержанием кислорода или вообще не содержащие его:
2KNO3 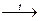 2KNO2 + O2
2KNO2 + O2
4Na2SO4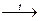 Na2S + 3Na2SO4
Na2S + 3Na2SO4
Номенклатура средних солей
Названия средних солей безкислородных кислот составляются от латинских названий кислотообразующих элементов с добавлением окончания “ид”.
Например: NaBr - бром ид натрия,
K2S - сульф ид калия, FeCl3- трихлор ид железа.
Названия солей кислородосодержащих кислот составляются от латинских названий кислотообразующих элементов с добавлением окончания:
· “-ат”, если атом в кислотном остатке находится в высшей степени окисления.
Например: +4
CaCO3 - карбон ат кальция,
+4
K2SiO3 - силик ат калия,
+3
NaAlO2 алюмин ат натрия;
· “-ит”, если атом в кислотном остатке находится в невысшей степени окисления (обычно ниже высшей на 2).
Например: +4
Na2SO3 - сульф ит натрия,
+3
KNO2 - нитр ит калия.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1886; Нарушение авторских прав?; Мы поможем в написании вашей работы!