
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение атома. Химические свойства веществ, проявляющиеся при химических реакциях, определяются природой атомов, их количеством и химическим строением
СТРОЕНИЕ ВЕЩЕСТВА
Химические свойства веществ, проявляющиеся при химических реакциях, определяются природой атомов, их количеством и химическим строением. Поэтому для понимания химических процессов и правильного написания химических реакций необходимо знать строение атомов химических элементов.
Атом – наименьшая частица материи, состоящая из ядра и электронной оболочки.
Элемент – группа атомов с одинаковым значением заряда ядра.
Ядро – это центральная, положительно заряженная часть атома, в которой сосредоточена почти вся его масса (≈99,97%).Заряд ядра соответствует порядковому номеру элемента в Периодической системе Д.И. Менделеева, так же как и число электронов. Индивидуальность атома сохраняется до тех пор, пока сохраняется целостность ядра. Атом может потерять или приобрести определенное количество электронов, но основная его индивидуальность при этом сохраняется. При изменении состава ядра меняется и характер атома.
В основу современной теории строения ядра атома легла протонно-нейтронная теория российских ученых Иваненко и Гапона. Они предложили следующую модель ядра.
Ядра всех атомов состоят из нуклонов - протонов и нейтронов. Протон – элементарная частица, имеющая заряд +1 и массу 1 (в атомных единицах массы - a.e.m) - 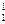 р. Число протонов равняется заряду ядра атома.
р. Число протонов равняется заряду ядра атома.
Нейтрон – нейтральная частица с массой 1 (в a.e.m) -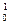 n.
n.
Число нейтронов определяется разностью между относительной атомной массой элемента (Аr) и числом протонов.
Например: определить заряд ядра(z), число электронов(е), протонов, нейтронов в атоме элемента лития
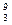 Li: z =+3, е =3,
Li: z =+3, е =3, 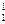 р = 3,
р = 3, 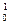 n = 9 – 3 = 4
n = 9 – 3 = 4
Разновидность атомов, имеющих одинаковое число протонов, но разные массовые числа, называется изотопами.
Например: 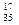 Cl,
Cl, 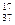 Cl.
Cl.
Для большинства веществ изотопы не оказывают влияния на химические свойства. Исключение H: 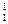 Н- протий,
Н- протий, 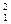 Н- дейтерий,
Н- дейтерий, 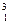 Н- тритий.
Н- тритий.
Разновидность элементов, у которых совпадают атомная масса, но разное число протонов, называется изобарами.
Например: 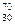 Zn,
Zn, 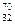 Ge.
Ge.
Квантово – механическая модель атома
Современная теория строения атома основана на теории квантовой механики, которая включает представления о квантовании энергии, о волновом характере движения микрочастиц и о вероятном или статистическом методе исследования частиц.
Основные положения теории квантовой механики:
· энергия испускается квантами (порциями, пучками). Энергия кванта Eкв = h∙ν, где
h – постоянная Планка (h = 6,63∙10-34 Дж/с), ν – частота излучения;
· микрочастицы обладают свойствами и частицы, и волны. Им присущи скорость, импульс, длина волны. Каждой частице соответствует волновой процесс с длиной волны λ. Эту двойственность Луи де Бройль (1924 г.) выразил уравнением:
λ = h/m∙υ, где λ – длина волны, m - масса микрочастицы, υ – ее скорость. Двойственная природа микрочастиц была доказана экспериментально при изучении дифракции, интерференции;
· в квантовой механике поведение частиц характеризуют принципом неопределенности Гейзенберга, согласно которому невозможно определить одновременно положение частицы в пространстве и ее импульс.
Можно оценить вероятность нахождения электрона в атоме с помощью волновой функции ψ, которая заменяет понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ2 определяет пространственное распределение электрона в атоме:
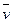 2ψ + 8π2m(E-V) / h2 = 0,где
2ψ + 8π2m(E-V) / h2 = 0,где
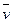 - оператор Лапласа, m -масса электрона, Е - энергия, h – постоянная Планка, V – потенциал ядра, ψ – волновая функция.
- оператор Лапласа, m -масса электрона, Е - энергия, h – постоянная Планка, V – потенциал ядра, ψ – волновая функция.
В наиболее простом варианте волновая функция зависит от трех пространственных координат и дает возможность определить вероятность нахождения электрона в атомном пространстве или его орбиталь. Таким образом, атомная орбиталь – область атомного пространства, в котором вероятность нахождения электрона наибольшая. Атомная орбиталь или плотность электронного облака, ее энергия и направление в пространстве зависят от четырех параметров – квантовых чисел (n, ℓ, m, s).
|
|
Дата добавления: 2014-10-15; Просмотров: 684; Нарушение авторских прав?; Мы поможем в написании вашей работы!