
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз растворов солей
|
|
|
|
(на примере водных растворов)
При электролизе водных растворов электролитов полярные молекулы воды притягиваются и к катоду, и к аноду, и также могут участвовать в процессах на электродах.
Процессы на катоде
Последовательность восстановления ионов на катоде при электролизе растворов зависит от значений стандартных электродных потенциалов потенциала восстановления водорода из воды.
Первыми на катоде восстанавливаются частицы с бόльшим электродным потенциалом.
Так как в нейтральном растворе концентрация ионов водорода равна 10-7 моль/л и по формуле Нернста:
e = e◦ + 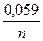 ∙ lg [ Н+ ] = 0 +0,059∙(-7) = -0,41В,
∙ lg [ Н+ ] = 0 +0,059∙(-7) = -0,41В,
то в зависимости от нахождения металла в ряду стандартных электродных потенциалов, выделяются три случая:
1) ионы металлов, электродный потенциал которых менее –1,18В (от Li до Mn в ряду стандартных электродных потенциалов) не восстанавливаются из водных растворов, вместо них восстанавливается водород из воды по уравнению:
2Н2О + 2е- = Н2 + 2ОН- рН >= 7
(в кислых средах- при рН < 7 восстановление водорода идет по уравнению: 2Н+ + 2е- = Н2)
2) ионы металлов, электродный потенциал которых от –1,18В до 0,00В (от Mn до Н) восстанавливаются одновременно с ионами водорода:
Men+ + ne- = Me0
2H2O + 2e- = H2 + 2OH- (рH>=7)
3) ионы металлов, электродный потенциал которых больше 0,00В (от H до Au) восстанавливаются без процесса восстановления водорода из воды:
Меn+ + ne- = Me0
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 395; Нарушение авторских прав?; Мы поможем в написании вашей работы!