
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические источники электрической энергии
|
|
|
|
Химические источники электрической энергии (ХИЭЭ) это устройства, в которых энергия окислительно-восстановительной реакции преобразуется в электрическую.
Если в ХИЭЭ протекают необратимые окислительно-восстановительные реакции – это гальванические элементы. Они используются однократно до полной разрядки (например, батарейки). Если в ХИЭЭ протекают обратимые окислительно–восстановительные реакции – это аккумуляторы, они используются многократно.
Рассмотрим устройство и принцип действия медно – цинкового гальванического элемента Даниэля – Якоби.
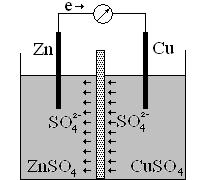
Медно-цинковый гальванический элемент состоит из цинковой и медной пластин, опущенных соответственно в растворы сульфата цинка и сульфата меди с концентрацией 1 моль/л (1М). Пластины соединены внешним проводником, а сосуды с раствором – электролитическим мостиком (трубка с раствором соли) или пористой перегородкой. О наличии тока в цепи можно судить по отклонению стрелки гальванометра.
В гальваническом элементе, на электроде, обладающем более низким потенциалом, накапливаются электроны. В элементе Даниэля-Якоби это цинк, его потенциал -0,76В. При соединении цинка и меди электроны переходят с цинка на медь:
Zn – 2e = Zn2+ - процесс окисления
Цинковая пластинка растворяется.
На медном электроде, который обладает более высоким потенциалом (е◦Сu/Сu2+ = +0,34В), ионы меди принимают электроны, находящиеся в растворе:
Cu2+ + 2e = Cu - процесс восстановления.
Цинковый электрод, на котором идет отдача электронов (процесс окисления), является анодом, имеет отрицательный заряд. На медном электроде идет восстановление – это катод. Катод в гальваническом элементе имеет положительный заряд. Значит, в гальваническом элементе роль анода выполняет всегда электрод, изготовленный из металла с более низким потенциалом, а роль катода – металл, имеющий более высокое значение электродного потенциала.
Итак, по внешней цепи в гальваническом элементе движутся электроны в направлении от анода к катоду, т.е. от более активного металла к менее активному - это электронная проводимость.
В растворах же наблюдается движение ионов – это ионная проводимость. Направление движения ионов (SO42-) происходит из раствора с катодом в раствор с анодом. Это связано с тем, что первоначально в растворах электролитов существует равенство катионов металлов и сульфат ионов. В процессе работы гальванического элемента на цинковом электроде катионы цинка, переходя в раствор, заряжают раствор положительно. На медном электроде катионы меди, переходя из раствора на медную пластину, заряжают раствор отрицательно за счет появления избытка сульфат ионов. Поэтому наблюдается направленное движение ионов (SO42-) от медного электрода к цинковому.
Гальванический элемент работает только при замыкании как внешней так и внутренней цепи.
В гальваническом элементе протекает следующая окислительно–восстановительная реакция:
На аноде: А(-): Zn - 2e 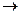 Zn2+
Zn2+
На катоде: K(+): Cu2+ + 2e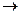 Cu0
Cu0
Суммарное ионное уравнение:
Zn + Cu2+ = Zn2+ + Cu
Молекулярное уравнение:
Zn + CuSO4 = ZnSO4 + Cu
Гальванический элемент можно записать в виде
электрохимической схемы:
А(-) Zn / ZnSO4 // CuSO4 / Cu K(+)
Краткая схема:
A(-) Zn / Zn2+ // Cu2+ / Cu K(+)
Электродвижущая сила гальванического элемента (Э.Д.С.) находится как разность электродных потенциалов катода и анода:
ЭДС = екатода - еанода
Например, ЭДС элемента Даниэля-Якоби для стандартных условий:
ЭДС = (+0,34) – (-0,76) = 1,10В
ЭДС элемента – величина положительная, т.к. окислительно –восстановительный процесс протекает самопроизвольно.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 537; Нарушение авторских прав?; Мы поможем в написании вашей работы!