
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аккумуляторы
|
|
|
|
Аккумуляторы относятся к вторичным источникам электрической энергии, работоспособность которых после разряда может быть восстановлена, т.е. в аккумуляторах используется обратимость токообразующей окислительно-восстановительной реакции.
Например, схема свинцового кислотного аккумулятора имеет вид:
Рb / Н2SO4 / PbO2
Раствор H2SO4 имеет концентрацию 33-40% (плотность 1,25…1,30). Токообразующая реакция выражается уравнением:
Pb + PbO2 + 2H2SO4 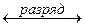 2PbSO4 +2H2O,
2PbSO4 +2H2O,
которое получили суммированием катодного и анодного процессов в режимах «разряд» и «заряд». В режиме «разряд» аккумулятор работает как гальванический элемент.
А(-) Pb + HSO - 2е
- 2е 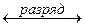 PbSO4
PbSO4 + H+
+ H+
K(+) PbO2 + HSO + 3H++ 2е
+ 3H++ 2е 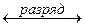 PbSO4 +2H2O
PbSO4 +2H2O
В режиме «заряд» под действием внешнего источника тока обеспечивается обратное разряду направление перемещения электронов. На катоде:
PbSO4 +H+ + 2e 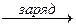 Pb + HSO
Pb + HSO
 (восстановление)
(восстановление)
Значит электрод Pb / PbSO4 – выполняет при зарядке функцию катода, а электрод PbSO4 / PbO2 – функцию анода:
PbSO4 + 2H2O 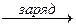 PbO2 + HSO
PbO2 + HSO + 3H+ + 2e (окисление)
+ 3H+ + 2e (окисление)
ЭДС свинцового аккумулятора составляет 2В. Т.к. в электродных процессах участвует серная кислота, то Э.Д.С. существенно зависит от концентрации кислоты в растворе. При разрядке H2SO4 расходуется, поэтому о степени разряда аккумулятора судят по концентрации электролита, измеряя его плотность.
Кроме кислотных аккумуляторов используются и щелочные аккумуляторы, но они имеют малую ЭДС (1,3…1,4В). Основное их преимущество в лучшей сохранности в перерывах в работе и большем сроке службы. Они используются для питания электрокаров, погрузчиков, различных электровозов.
Большинство аккумуляторов допускает проведение большого числа циклов «заряд-разряд», т.к. в режиме «заряд» в аккумуляторе (в виде химической энергии) накапливается энергия внешнего источника, в режиме «разряд» они возвращаются потребителю.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 369; Нарушение авторских прав?; Мы поможем в написании вашей работы!