
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислая среда
|
|
|
|
Метод полуреакций или ионно-электронный метод
Этот метод основан на составлении ионных уравнений для процессов окисления восстановителя и для реакций восстановления окислителя с последующим суммированием обеих уравнений в общее ионное уравнение.
Чтобы составить уравнение окислительно-восстановительной реакции методом полуреакций, необходимо:
1) составить ионно-молекулярную схему реакции, учитывая, что сильные электролиты записываются в виде ионов, а слабые электролиты (газы, осадки) - в виде молекул;
2) оставим в ионно-молекулярной схеме реакции ионы, содержащие элементы, меняющие степень окисления (окислитель, восстановитель) а также ионы Н+ и ОН-, характеризующие среду или молекула воды;
3) составить электронно-ионные уравнения отдельно для процессов восстановления и окисления, руководствуясь следующими правилами:
· если процесс протекает в кислой среде, то в ту часть полуреакции, где меньше атомов кислорода добавляют такое количество молекул воды, сколько кислорода не хватает, а в противоположную часть – соответсвующее число ионов водорода Н+. В результате число атомов элементов правой и левой частей полуреакций должно быть одинаковым
· если процесс протекает в щелочной среде, то в ту часть, в которой не хватает кислорода добавляют в два раза больше ионов ОН-, чем не хватает кислорода, а впротивоположную часть – соответствующее количество молекул воды;
· если процесс протекает в нейтральной среде, то в левую часть полуреакции всегда добавляют молекулы воды, а в правую - либо ионы Н+ либо ОН-
На основании закона сохранения массы и энергии, в левой и правой частях уравнения должно быть равенство числа частиц (ионов, атомов, молекул). Суммарное число и знак электрических зарядов слева и справа от знака равенства должны быть одинаковы.
Например:
1) в кислой среде:
Рассмотрим реакцию восстановления перманганата калия по схеме
KMnO4 +Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O:
Запишем уравнение в ионно-молекулярном виде:
K ++(MnO4)-+ 2Na ++(SO3)2-+2H++ (SO 4 ) 2-→ Mn2++ (SO 4 )2 -+ 2Na ++(SO4)2-+ 2K+ + (SO 4 ) 2-+H2O
Составляем ионно-молекулярную схему реакции, показывающую ионы, содержащие элементы, меняющие степень окисления и ионы среды:
(MnO4)- + (SO3)2- + H+ → Mn2+ + (SO4)2- + H2O
Составляем схемы превращений ионов:
(SO3)2- → (SO4)2-
(MnO4)- → (Mn)2+
Недостаток кислорода восполним молекулой воды, т. к. среда кислая, и уравняем число атомов водорода:
(SO3)2- + H2O = (SO4)2- + 2H+
(MnO4)- + 8H+ = Mn2+ + 4H2O
Сосчитаем заряды в левой и правой частях схемы и найдем число отданных и принятых электронов.

 5 (SO3)2- + H2O - 2e- = (SO4)2- + 2 H+ процесс окисления
5 (SO3)2- + H2O - 2e- = (SO4)2- + 2 H+ процесс окисления
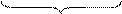 | 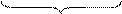 |
10 -2 0
восстановитель
2 (MnO4)- + 8H+ + 5e- = Mn2+ + 4H2O процесс восстановления
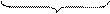 | 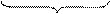 |
+7 +2
окислитель
Уравниваем число отданных и принятых электронов, найдя множители 2 и 5. Умножаем каждое уравнение на соответствующий множитель и почленно складываем их (электроны при этом сокращаются), получаем:
5(SO3)2- + 5H 2 O +2(MnO4)- + 16H+ = 5(SO4)2- + 10H+ + 2Mn2+ + 8H 2 O
Приводим подобные члены:
5(SO3)2- + 2(MnO4)- + 6H+ = 5(SO4)2- + 2Mn2+ + 3H2O
От полученного ионно-молекулярного уравнения переходим к полному молекулярному уравнению, при этом коэффициенты, находящиеся перед ионами ставим перед молекулами содержащие эти ионы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + 3H2O
2 ) в нейтральной среде:
KMnO4 + Na2SO3 + H2O → MnO2 + KOH + Na2SO3
нейтральная
срела
K+ +(MnO4)- +2Na+ +(SO3)2 +H2O → MnO2 +K+ +OH- +2Na+ +(SO3)2-
(MnO4)- +(SO3)2 +H2O→ MnO2 + OH +(SO3)2-
(MnO4)- + 2H2O = (MnO2)- + 4OH-
(SO3)2- + H2O = (SO4)2- + 2H+


 2 (MnO4)- + 2H2O +3e = (MnO2)- + 4OH- процесс восстановления
2 (MnO4)- + 2H2O +3e = (MnO2)- + 4OH- процесс восстановления
6 -1 -4
3 (SO3)2- + H2O – 2e = (SO4)2- + 2H+ процесс окисления
 |  |
-2 0
 |
2MnO4- + 4H2O + 3SO32- + 3H2O = 2MnO2 + 8OH- + 3SO42- + 6H+
2MnO4- + 7H2O + 3SO32- = 2MnO2 + 6H2O + 3SO42- + 2OH-
2MnO4- + H2O + 3SO32- = 2MnO2 + 3SO42- + 2OH-
В молекулярном виде:
2KMnO4 + H2O + 3Na2SO3 = 2MnO2 + 3Na2SO4 + 2KOH
3) в щелочной среде:
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1154; Нарушение авторских прав?; Мы поможем в написании вашей работы!