
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции в растворах
|
|
|
|
Ионное произведение воды
Электролитическая диссоциация молекул воды.
Вода является очень слабым электролитом. Электролитическая диссоциация воды выражается следующим уравнением:
Н2О ↔ Н+ + ОН-
Это обратимый процесс. Константа диссоциации запишется:
KД = 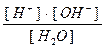 , где
, где
 = [Н+]∙[ОН-] – эта величина называется ионным произведением воды.
= [Н+]∙[ОН-] – эта величина называется ионным произведением воды.
Это уравнение показывает, что для воды при постоянной температуре произведение концентрации ионов водорода и гидроксид-ионов есть величина постоянная, равная
[Н+]∙[ОН-] = 10-14 мол/л (при 220С)
В зависимости от концентрации ионов водорода различают нейтральную, кислую и щелочную среду.
Растворы, в которых
[Н+]= [ОН-]= 10-7 мол/л имеют нейтральную среду,
[Н+] < 10-7 мол/л (10-8, 10-9 и т.д.) – щелочную,
[Н+] > 10-7 мол/л (10-6, 10-5 и т.д.) – кислую.
Для характеристики среды обычно используется величина водородного показателя (рН) - это отрицательный логарифм концентрации катионов водорода в растворе:
рН = - lg [Н+]
рН = 7 – нейтральная среда,
рН < 7 – кислая среда,
рН > 7 – щелочная среда.
Например: для 0,01М раствора HCl рН = - lg 10-2 = 2,
для 0,01М раствора NaOH рН = - lg 10-12 = 12.
ГЛАВА 5
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 411; Нарушение авторских прав?; Мы поможем в написании вашей работы!