
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сильные и слабые электролиты
|
|
|
|
Диссоциация основных солей
Диссоциация кислых солей
Диссоциация средних солей
Диссоциация оснований
Диссоциация кислот
Диссоциация кислот, оснований, солей
Теория электролитической диссоциации создана С. Аррениусом, основные положения которой заключаются в следующем:
· при растворении электролитов происходит диссоциация (распад) их молекул на заряженные частицы – ионы;
· при диссоциации устанавливается термодинамическое равновесие между образовавшимися ионами и молекулами;
· величина заряда иона совпадает с валентностью атома элемента или кислотного остатка, а число положительных зарядов равно числу отрицательных зарядов;
· в целом раствор нейтрален. Растворы электролитов проводят электрический ток. Они являются проводниками «второго рода».
Согласно современной теории растворов диссоциация происходит в результате взаимодействия растворённого вещества с молекулами растворителя. Хорошо диссоциируют молекулы с ионной и ковалентной полярной связью. Неполярные и малополярные молекулы не диссоциируют или диссоциируют очень мало. На диссоциацию электролитов в значительной степени влияет полярность растворителя. Чем выше полярность растворителя, тем выше степень диссоциации электролита.
С точки зрения электролитической диссоциации кислотами называются электролиты, образующие в водных растворах ионы водорода (Н+).
Например:
НСl = H+ + Cl-
Многоосновные кислоты диссоциируют ступенчато:
H2S ↔ H+ +НS- I ступень
HS-↔ H+ + S2- II ступень
H2S↔ 2H+ + S2- суммарное уравнение диссоциации
CH3COOH ↔ H+ + CH3COO -
Основаниями называются электролиты, диссоциирующие в водном растворе с образованием гидроксид-ионов (ОН-).
Например:
NaOH = Na+ + OH-
NH4OH ↔ NH+4 + OH-
Например:
NaCl = Na+ + Cl-
NiSO4 = Ni2+ + SO42-
K3PO4 = 3K+ + PO43 -
КНSО4 = К+ + (НSО4)-
СаОНСI = (СаОН)+ + СI-
Изучение свойств растворов электролитов показало, что в растворах наряду с ионами присутствуют и молекулы, так как диссоциация происходит не полностью. Долю диссоциированных молекул характеризует степень диссоциации. Степень диссоциации(a) – это отношение числа распавшихся на ионы молекул (n) к общему числу растворённых молекул N: a = n /N
Например: a = 20 %. Это значит, что из 100 молекул электролита 20 молекул распалось на ионы, КА ↔ К+ + А- и в растворе присутствует 40 ионов, а также 80 нераспавшихся молекул. Всего в растворе будет присутствовать 120 частиц.
Степень диссоциации зависит от концентрации электролита, от температуры. С уменьшением концентрации и повышением температуры степень диссоциации возрастает.
Все электролиты по степени диссоциации делятся на сильные и слабые. Условно электролиты, для которых степень диссоциации больше 50 % относят к сильным, а для которых меньше чем 50 % - к слабым.
К сильным электролитам относятся:
· СОЛИ, растворимые в воде;
· ОСНОВАНИЯ элементов 1 и 2 групп главных подгрупп;
· КИСЛОТЫ Н2SO4, HNO3, HCl, HBr, HJ, HMnO4, HClO4, HClО3 и другие.
К слабым электролитам относятся:
· ВОДА;
· СОЛИ, нерастворимые в воде;
· ОСНОВАНИЯ НЕРАСТВОРИМЫЕ в воде и NH4OH;
· КИСЛОТЫ органические (такие как уксусная - СН3СООН), H2S, H2CO3, H2SiO3, H3BO3 и другие.
Принято, что сильные электролиты при растворении в воде полностью диссоциируют на ионы, а слабые электролиты - лишь частично.
Чтобы исключить влияние концентрации электролита для характеристики диссоциации используют константу диссоциации. Т.к. диссоциация является обратимым процессом:
КА ↔ К+ + А-,
то по закону действующих масс:
→ → ← ←
υ = k·[КА], υ = k·[К+]·[А-], тогда
→ ←
k · k·[КА] = k ∙[К+]·[А-]
→ ←
В состоянии равновесия υ = υ, следовательно
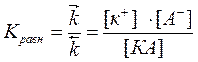 - константа диссоциации Кд.
- константа диссоциации Кд.
Константа равновесия является количественной характеристикой диссоциации. KД зависит от температуры и не зависит от концентрации раствора. По величине KД можно судить о силе электролита.
Например: для одной и той же температуры:
KД(СН3СООН) = 1,75·10-5; KД(HСN) = 7,9·10-10, следовательно более сильным электролитом является уксусная кислота.
Если многоосновные слабые кислоты и основания диссоциируют по ступеням, то каждая ступень характеризуется своей константой диссоциации, причем константа диссоциации по каждой последующей ступени на несколько порядков ниже, чем по предыдущей.
Например: Н2СО3↔ НСО3- + Н+, Кд = 4,45·10-7
НСО3-↔ СО32- + Н+, Кд = 4,8·10-11
Связь константы диссоциациисо степенью диссоциации выражается законом разбавления Оствальда:
Кд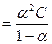 , где
, где
С – молярная концентрация раствора;
ά – стапень диссоциации
Для очень слабых электролитов при α<<1 это уравнение упрощается:
Кдис = α2 · СM и α2 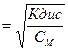
Отсюда следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2418; Нарушение авторских прав?; Мы поможем в написании вашей работы!