
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей, образованных сильными кислотами и слабыми основаниями
|
|
|
|
Гидролиз солей
Осадок
Реакции ионного обмена
В растворах реакции протекают в результате обмена ионами реагирующих веществ – реакции ионного обмена. Они протекают до конца (необратимо), если в результате реакции:
· выделяется газ;
· выпадает осадок;
· образуется слабый электролит.
Эти процессы отображают с помощью уравнений в молекулярной, ионно-молекулярной и краткой ионной форме.
Например:
1. AgNO3 + КСl = AgCl↓ + KNO3 – молекулярное уравнение
Затем это уравнение записывают в ионно-молекулярной форме: в виде ионов записываются молекулы сильных электролитов (здесь - AgNO3, КСl, KNO3), а малорастворимые соединеиния (здесь – AgCl), слабые электролиты, газообразные и комплексные соединения пишутся в виде молекул:
Ag+ + NO3 - + К + + Сl- = AgCl↓ + К + + NO3 - - полное ионно- молекулярное уравнение
Сущность протекающей реакции отражает краткое ионно-молекулярное уравнение, которое получается путем сокращения одинаковых ионов в обеих частях уравнения:
Ag+ + Сl- = AgCl↓ - сокращенное ионно-молекулярное уравнение
Данный процесс необратим, так как образуется нерастворимое соединение.
2. Для реакции
2НСl + Na2S = Н2S↑ + 2NaCl
2Н+ + 2Сl - + 2Na + + S2- = Н2S↑ + 2Na + + 2Сl -
слабый
электролит
краткое ионно – молекулярное уравнение имеет вид:
2Н+ + S2- = Н2S↑
Процесс необратим, так как образуется слабый электролит.
3. Нередко встречаются обратимые процессы, в уравнениях которых в левой и правой частях уравнения имеются слабые электролиты
Mg(ОН)2 +2НСl ↔ MgCl2 +2Н2О
Mg(ОН)2 + 2Н+ + 2Сl- ↔ Mg+2 + 2Сl- +2Н2О
Mg(ОН)2 + 2Н+ ↔ Mg+2 +2Н2О
Гидролизом соли называется реакция обменного взаимодействия соли с водой с образованием слабого электролита и изменением рН раствора.
Гидролиз протекает по ступеням (в реальных условиях только по первой ступени). При этом с молекулами воды взаимодействует «слабая часть» соли, а рН определяется «сильной » ее частью.
Возможны следующие случаи гидролиза:
Например: гидролиз FеСl3 (соль образована сильной кислотой НСI и слабым нерастворимым основанием Fе(ОН)3).
В растворе FeCl3 диссоциирует на ионы:
FeCl3 = Fе3+ + 3CI-
Гидролиз протекает по катиону Fе3+(«слабой» части соли) в три ступени:
I ступень: Fе3+ + (Н+ОН-) ↔ FeОН2+ + Н+- в ионно-молекулярном виде;
FeCl3 + Н2О ↔ FeОНСl2 + НСl.- в молекулярном виде
II ступень: FeОН2+ + Н2О ↔ Fe(ОН) 2+ + Н+
FeОНСl2 + Н2О ↔ Fe(ОН)2Сl + НСl.
III ступень: Fe(ОН) 2+ + Н2О↔ Fe(ОН)3 + Н+;
Fe(ОН)2Сl+ Н2О↔ Fe(ОН)3+ НСl.
В результате гидролиза на каждой ступени образуется катион Н+,следовательно, в растворе кислая среда (рН<7).
Таким образом, гидролиз соли, образованной слабым основанием и сильной кислотой, протекает по катиону металла; в растворе – кислая среда (рН<7).
2. Гидролиз солей, образованных сильными основаниями и слабыми кислотами (Na2CO3, К2S, Na3РО4, СН3СОО Na и др.).
Например: гидролиз Na3РО4
В растворе Na3РО4 диссоциирует на ионы:
Na3РО4= 3Na+ + РО43-.
Соль образована сильным основанием NaОН и слабой кислотой Н3РО4, поэтому гидролиз будет протекать по аниону РО43-:
I ступень: РО43- + Н2О ↔ НРО42- + ОН-,
Na3РО4 + Н2О ↔ Na2НРО4 + NaОН.
II ступень: НРО42- + Н2О ↔ Н2РО4- + ОН-,
Na2НРО4 + Н2О ↔ NaН2РО4 + NaОН.
III ступень: Н2РО4-+ Н2О↔ Н3РО4 + ОН-,
NaН2РО4 + Н2О↔ Н3РО4 + NaОН.
В результате гидролиза на каждой ступени образуется анион ОН-, следовательно, в растворе щелочная среда (рН>7).
Таким образом, гидролиз соли, образованной сильным основанием и слабой кислотой, будет протекать по аниону кислотного остатка («слабой части» соли); в растворе – щелочная среда (рН>7).
3. Гидролиз солей, образованных слабыми кислотами и слабыми основаниями (Fе(СН3СОО)3 и др.).
Пример: гидролиз ацетата аммония СН3СООNН4.
В растворе СН3СОО NН4, как сильный электролит, диссоциирует на ионы:
СН3СОО NН4 = NН4+ + СН3СОО-
Соль образована слабым основанием NН4ОН и слабой кислотой СН3СООН, поэтому гидролиз будет протекать и по катиону NН+4, и по аниону СН3СОО-:
NН4+ + Н2О ↔ NН4ОН + Н+,
СН3СОО- + Н2О ↔ СН3СООН+ ОН-,
NН4+ + СН3СОО- + Н2О ↔ NН4ОН + СН3СООН,
СН3СОО NН4 + Н2О ↔ NН4ОН + СН3СООН.
В результате гидролиза образуется анион ОН- и катион Н+, которые связываются в воду, в растворе нейтральная среда (рН=7). (Чаще всего раствор таких солей имеет слабокислую (рН=5-6) или слабощелочную среду (рН=8-9), что зависит от силы кислоты и основания образующих соль).
4. Гидролиз солей, образованных сильными кислотами и сильными основаниями (СаСl2, Nа2SО4, NaNО3, КСl и др.).
Соли данного типа гидролизу не подвергаются, раствор нейтрален (рН = 7), индикатор окраски не меняет.
5. Совместный гидролиз
Если в гидролизе участвуют одновременно растворы двух солей, одна из которых образованна катионом слабого основания(гидролизуется по катиону), а другая анионом слабой кислоты (гидролизуется по аниону), то произойдёт совместный гидролиз. В этом случае соли усиливают гидролиз друг друга и процесс протекает необратимо, то есть до конца.
Например:
2СrСl3 + 3Na2S +6Н2О ↔ 6NаСl + 2Сr(ОН)3↓ + 3Н2S↑ - суммарное ионно-молекулярное уравнение,
где СrСl3 гидролизуется по катиону:
Сr3++Н+ОН-↔ СrОН2++Н+ (I ступень, конечный продукт гидролиза - гидроксид хрома (III) Сr(ОН)3),
а Na2S – по аниону:
S2-+ Н+ОН-↔НS-+ОН- (I ступень, конечный продукт гидролиза - Н2S)
Количественно процесс гидролиза характеризуетсястепенью гидролиза h и константой гидролиза Кг.
Степень гидролиза показывает отношение числа гидролизовавшихся молекул к общему числу молекул соли в растворе:
h=Cгидр молекул/Cобщее число молекул
Степень гидролиза зависит от концентрации и температуры. Наиболее общую характеристику гидролиза даёт константа гидролиза, т.к. она зависит только от температуры.
Например:
S2-+ Н+ОН-↔НS-+ОН- - I ступень
Кг1 ,
,
НS-+ Н+ОН-↔ Н2S+ОН- - II ступень
Кг2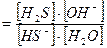
Т.к. концентрация воды изменяется мало при гидролизе, то её принимают постоянной.
Кг1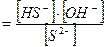 Кг2
Кг2
Связь константы и степени гидролиза выражается уравнением аналогичным закону разбавления Оствальда:
Кг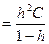 ,
,
Следовательно, Кr для солей, образованных слабой кислотой и сильным основанием:
Кг= Кд (H2O) / Кд (кислоты)
для солей, образованных сильной кислотой и слабым основанием
Кг= Кд (H2O) / Кд (основания)
для солей, образованных слабой кислотой и слабым основанием

Кг= Кд (H2O) / Кд (основания) ∙ Кд (кислоты)
На состояние равновесия процесса гидролиза влияет температура и концентрация. Смещение равновесия гидролиза происходит в соответствии с принципом Ле-Шателье. Гидролиз – это эндотермический процесс (идет с поглощением тепла). Поэтому увеличение температуры усиливает гидролиз (т.е. смещает равновесие вправо). Гидролиз усиливается при разбавлении водой и при удалении продуктов гидролиза. Гидролиз подавляется, равновесие смещается влево, если увеличивать концентрацию продуктов гидролиза. Гидролиз может протекать необратимо, если продукты гидролиза уходят из сферы реакции (выпадение осадка, выделение газа).
Например: чтобы затормозить гидролиз Na2S:
S2-+ Н+ОН-↔НS-+ОН- - I ступень,
необходимо:
а) понизить температуру, так как при этом равновесие смещается всегда в сторону экзотермического процесса (с выделением тепла), которым и является обратная реакция;
б) добавить щелочь или повысить рН, так как при этом увеличится концентрация ОН-, которая является продуктом реакции, а при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 7121; Нарушение авторских прав?; Мы поможем в написании вашей работы!