
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения серы (II).Сероводород и сульфиды
|
|
|
|
Строение молекул H2S
Химическое строение молекул H2S аналогично строению молекул H2O (угловая форма).
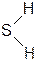
Но, в отличие от воды, молекулы H2S малополярны; водородные связи между ними не образуются; прочность молекул значительно ниже.
Физические свойства.
H2S -бесцветный газ с чрезвычайно неприятным удушливым запахом, очень ядовитый.
Сероводород в природе.
H2S присутствует в вулканических и подземных газах, в воде серных источников. Он образуется при гниении белков, содержащих серу, а также выделяется в процессе жизнедеятельности многочисленных микроорганизмов.
Химические свойства H2S
H2S- сильный восстановитель.
Взаимодействие H2S с окислителями приводит к образованию различных веществ (S, SO2, H2SO4) в зависимости от силы и концентрации окислителя и ряда других факторов.
а) реакции с простыми веществами окислителями:
окисление кислородом воздуха:
2H2S+3O2(изб)=2SO2+2H2O;
2H2S+O2(недостаток)=2S +2H2O.
окисление галогенами:
H2S+Br2=S+2HBr.
б) реакции с окисляющими кислотами (HNO3, H2SO4(конц):
3H2S+8HNO3(разб)=3H2SO4+8NO+4H2O;
H2S+8HNO3(конц))=H2SO4+8NO2+4H2O;
H2S+H2SO4(конц)=S+SO2+2H2O
в) реакции с солями-окислителями:
5H2S+2KMnO4+3H2SO4=5S+2MnSO4+K2SO4+8H2O
5H2S+6KMnO4+9H2So4=5SO2+6MnSO4+3K2SO4+14H2O
H2S+2FeCl3=S+2FeCl2+2HCl.
Водный раствор H2S проявляет свойства слабой кислоты (сероводородная кислота).
2-х основная кислота H2S диссоциирует ступенчато.
1-ая ступень: H2S ⇆ H+ + HS-
2-ая ступень:HS- ⇆ H++S2-
Для H2S в водном растворе характерны реакции, общие для класса кислот, в которых она ведет себя как слабая кислота. Взаимодействует:
а) с активными металлами:
H2S+Mg=H2↑+MgS;
б) с малоактивными металлами в присутствии окислителей:
2H2S+4Ag+O2=2Ag2S↓ +2H2O;
в) с основными оксидами:
H2S+BaO=BaS+H2O;
г) со щелочами:
H2S+NaOH(недостаток)=NaHS+H2O;
H2S + 2NaOH(избыток) = Na2S+2H2O;
д) с аммиаком:
H2S+2NH3(избыток)=(NH4)2S
Особенности реакций H2S с солями сильных кислот.
Несмотря на то, что сероводородная кислота – очень слабая, она реагирует с некоторыми солями сильных кислот, например:
CuSO4+H2S=CuS↓+H2SO4
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 787; Нарушение авторских прав?; Мы поможем в написании вашей работы!