
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Простые вещества
|
|
|
|
Отличие кислорода от других элементов подгруппы
Валентные состояния атомов подгруппы серы
Вертикальные изменения свойств элементов
От кислорода к теллуру в подгруппе серы заряд ядра растет, число электронных слоев и радиус атома увеличиваются, электроотрицательность и неметаллические свойства уменьшаются.
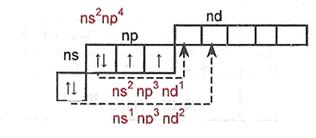
В невозбужденных атомах имеются 2 неспаренных электрона, которые участвуют в образовании ионных или ковалентных связей с другими атомами (валентность=2).
Вступая во взаимодействие с более ЭО атомами, сера, селен и теллур (а также Ро) могут переходить в возбужденные состояния, что сопровождается переходом электронов на вакантные d-орбитали.
При этом число неспаренных электронов увеличивается до 4-х или 6-ти, вследствие чего атомы могут проявлять валентность, равную IV, VI.
В атомах О валентные электроны размещаются на втором энергетическом уровне, имеющем только s- и р-орбитали. Это исключает возможность перехода атомов О в возбужденные состояния, поэтому кислород во всех соединениях проявляет постоянную В=2. Имея высокую ЭО (уступает только фтору), атомы кислорода всегда в соединениях заряжены отрицательно (с.о.=-2 или -1). Исключение - фториды ОF2 и О2F2.
Простые вещества, образуемые элементами данной подгруппы существуют в виде различных аллотропных модицикаций.

Кроме газообразных кислорода и озона, все остальные простые вещества при обычной температуре – твердые.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 677; Нарушение авторских прав?; Мы поможем в написании вашей работы!