
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Соединения фосфора (-III)
|
|
|
|
Способы получения
Соединения фосфора (-III). Фосфиды. Фосфин
При нагревании фосфор окисляет почти все металлы, образуя фосфиды. Фосфиды s-элементов II группы состава Э3Р2 солеподобны, легко разлагаются водой:
Mg3P2 + 6H2O = 3 Mg(OH)2 + 2 PH3
Фосфиды d-элементов (обычно типа МР, МР2, М3Р) имеют серый или черный цвет, металлический блеск и электрическую проводимость. Фосфиды этого типа химически малоактивны.
Ковалентным фосфидом является фосфид водорода РН3 – фосфин.
Фосфин получают косвенным путем. Образуется фосфин при гидролизе некоторых фосфидов, а также при диспропорционировании фосфора в щелочной среде при нагревании:
0 +1 -3
2 Р4 + 3 Ва(ОН)2 + 6 Н2О = 3 Ва(РО2Н2)2 + 2 РН3
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3↑
Zn3P2 + 6HCl = 3ZnCl2 + 2PH3↑
PH4I 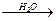 HI + PH3↑
HI + PH3↑
Фосфин – чрезвычайно ядовитый газ с неприятным запахом. В воде фосфин растворяется, но соединений при этом не образует.
Электронодонорные свойства фосфин проявляет только при действии на него наиболее сильных доноров протонов (HClO4, HI), например, при смешении газообразных РН3 и НI:
РН3(г) + НI(г) = РН4I
При этом образуются малоустойчивые бесцветные кристаллические вещества – производные иона фосфония РН4+. Соли фосфония разлагаются водой.
Фосфин и производные фосфония – сильные восстановители (сильнее, чем аммиак). При температуре ~ 150°С происходит его самовозгорание, иногда со взрывом. Образуется фосфорная кислота:
PH3 + 2O2 = H3PO4
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1176; Нарушение авторских прав?; Мы поможем в написании вашей работы!