
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Молекулярная формула - H2S2O8
|
|
|
|
Графическая формула
Серная кислота
Графическая формула
Надсерная кислота
Молекулярная формула - H2S2O8

Надсерная кислота или пероксодисерная кислота, мало устойчива.
H2S2O8 + 2 H2O = 2 H2SO4 + H2O2
H2S2O8 + H2O2 = 2 H2SO5
Соли надсерной кислоты перексосульфаты (VI) – сильные окислители. Используются при проведении химического анализа. Обугливает бумагу, сахар и парафин. Используются для обнаружение катионов марганца.
2 MnSO4 + 5 (NH4)2S2O8 + 8 H2O = 2 HМnO4 + 5 (NH4)2SO4 + 7 H2SO4
 Mn+2 - 5e = Mn+7 2
Mn+2 - 5e = Mn+7 2
(S2O8)2- + 2e = 2SO42- 5
Физические свойства
Молекулярная формула H2SO4
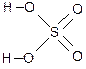
Безводная H2SO4 при обычных условиях – бесцветная маслянистая жидкость, не имеющая запаха, нелетучая. Она растворяется в воде в неограниченных количествах, при этом выделяется большое количество теплоты, так как происходит образование гидратов
H2SO4 - cильная кислота.
Ступенчатая диссоциация:
1-я ступень: H2SO4 ⇆ H⁺+HSO₄-
2-я ступень: HSO₄-⇆H⁺+SO₄2-
Можно считать, что в разбавленных растворах диссоциирована полностью:
H2SO4 ⇆ 2H++SO42-
Химические свойства разбавленной и концентрированной различаются.
Разбавленная H2SO4 проявляет общие свойства кислот, обусловленные наличием H+.
Разбавленная H2SO4 взаимодействует:
а. С Ме (до H):
H2SO4 + Zn = H2 + ZnSO4;
б. С основными и амфотерными оксидами:
H2SO4 + MgO = MgSO4 + H2O;
3 H2SO4 + Al2O3 = Al2(SO4)3 +3H2O;
в. С основаниями и амфотерными гидроксидами:
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O;
3 H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O;
г. С солями слабых кислот:
H2SO4 + Na2CO3 = Na2SO4 + CO2 +H2O
д. С аммиаком:
H2SO4 + NH3 = NH4HSO4;
H2SO4 + 2NH3 = (NH4)2SO4
Концентрированная H2SO4 –сильный окислитель
а. Окисление металлов.
Концентрированная серная кислота растворяет не только металлы, расположенные в ряду напряжений до водорода, но и такие малоактивные металлы, как Cu, Hg, Ag. Водород при этом не выделяется, поскольку роль окислителя в конц. H2SO4 играют анионы SO42-, а не ионы H+.
Продукты восстановления H2SO4 зависят от активности металла:
· Реакция с мало-и среднеактивными Ме:
2 H2SO4 + Cu = CuSO4 + SO2↑ + 2H2O;
· Реакции с активными Ме:
4 H2SO4 +3Zn = 3ZnSO4 + S↓ + 4H2O;
· Реакции со щелочными и щелочно-земельными Ме:
5 H2SO4 + 8Na = 4 Na2SO4 + H2S↑ + 4H2O
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 3048; Нарушение авторских прав?; Мы поможем в написании вашей работы!