
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хлор и его соединения
|
|
|
|
Свободный хлор Cl2
Физические свойства: Cl2 – газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха.
Химические свойства
Хлор – очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-
Cl2 + 2e → 2Cl-
1. Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Cl2 + 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водяными растворами:
Cl2 + Cu = CuCl2
3Cl2 + 2Au = 2AuCl3
2. Реакции с неметаллами
Хлор непосредственно не взаимодействует только с О2, N2, C. С остальными неметаллами реакции протекают при различных условиях. Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Cl2 + H2  2HCl
2HCl
Cl2 + 2S(расплав)  S2Cl2
S2Cl2
3Cl2 + 2P = 2PCl3 (или PCl5 – в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 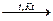 2I+3Cl3-1
2I+3Cl3-1
3. Вытеснение свободных неметаллов из их соединений:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
3Cl2 + 2NH3 = N2 + 6HCl
Диспропорционирование хлора в воде и водных растворах щелочей.
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3–.
Cl2 + H2O = HCl + HClO (хлорная вода)
Cl2 + 2KOH = KCl + KClO + H2O (жавелевая вода)
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
3Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O (хлорная известь)
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора: KClO и Ca(ClO)2 – гипохлориты; KClO3 – хлорат калия (бертолетова соль).
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1199; Нарушение авторских прав?; Мы поможем в написании вашей работы!