
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Галогениды
|
|
|
|
Галогенидами называют бинарные соединения галогенов с другими элементами общей формулы ЭHalx-1 (где х – чаще всего целые числа от 1 до 7).
Галогениды типичных металлов – ионные соединения (соли); галогениды неметаллов – ковалентные соединения.
Физические свойства солей MeHalx.
Наиболее распространенными и практически важными являются соединения галогенов с активными металлами (щел., и щел.-зем. Ме). Эти вещества представляют собой типичные соли: они тугоплавки, малолетучи, х. р. в воде и полностью диссоциируют на ионы как в растворах, так и в расплавах.
Химические свойства
Идентификация различных галогенид-ионов в водных растворах
Ионные фториды, хлориды, бромиды и йодиды по химическим свойствам во многом также сходны. Часто возникает необходимость распознать эти соли в растворе, то есть провести качественный анализ. В зависимости от конкретной задачи применяют один из следующих способов:
Групповой реактив для обнаружения ионов Hal¯ в растворе и отличия их друг от друга – р-р AgNO3. Анализ основан на различной растворимости и различной окраске галогенидов серебра AgHal:
F¯ + Ag+ = AgF (соль х.р. в воде)
Cl¯ + Ag+ = AgCl ↓(белый творожистый осадок)
Br¯ + Ag+ = AgBr ↓(желто-белый осадок)
I¯ + Ag+ = AgI ↓(желтый осадок)
Важным свойством AgCl, AgBr, AgI является их нерастворимость не только в воде, но и кислотах.
Анионы Br¯ и I¯можно обнаружить с помощью какого-либо окислителя, например при пропускании газообразного Cl2 через водный раствор бромида или йодида:
2Br¯ + Cl2 = 2Cl¯ + Br2 (бурый цвет)
2I¯ + Cl2 = 2Cl¯ + I2 (красно-бурый цвет)
Выделяющийся I2 можно также определить очень чувствительной йод крахмальной реакцией.
Идентификация твердых галогенидов с помощью конц. H2SO4.
Анализ основан на летучести HHal и различной восстановительной активности анионов Hal¯.
1. Под действием конц. H2SO4 из твердых фторидов и хлоридов вытесняются HF и HCl:
2KF + H2SO4  K2SO4 + 2HF ↑
K2SO4 + 2HF ↑
2KCl + H2SO4  K2SO4 + 2HCl ↑
K2SO4 + 2HCl ↑
2. Из бромидов и йодидов соответствующие галогеноводороды под действием конц. H2SO4 не выделяются, так как окисляются далее до свободных галогенов.
Электролиз расплавов галогенидов
Это очень важный процесс, который используют для получения щел. и щел.-зем. металлов. промышленный и основной лабораторный метод получения F2 - электролиз расплавов KHF2.
Электролиз водных растворов NaCl и KCl
Этот процесс широко используется в промышленности для одновременного производства щелочей NaOH и KOH, водорода и хлора:
2MeCl2 + 2H2O 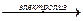 2MeOH + Cl2 ↑ + H2 ↑
2MeOH + Cl2 ↑ + H2 ↑
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2915; Нарушение авторских прав?; Мы поможем в написании вашей работы!